

发布时间:2024-06-21
2024年6月18日,中国科学院广州生物医药与健康研究院唐士兵研究员与浙江大学杨兵研究员、北京航空航天大学刘超副教授团队合作,报道了一种新型氟磺酸类可富集化学交联的非天然氨基酸并在活细胞中研究蛋白质相互作用。相关成果以“Characterize direct protein interactions with enrichable, cleavable and latent bioreactive unnatural amino acids”为题发表在学术期刊Nature Communications。
蛋白质-蛋白质相互作用鉴定是蛋白质功能研究的重要步骤,在活细胞中原位鉴定相互作用蛋白对于生物医药研究具有重要意义。基于邻近触发反应(proximity-enabled reactivity)的化学交联非天然氨基酸可以捕获弱作用力和瞬时蛋白质相互作用,已被开发用于原位鉴定活细胞中的蛋白质相互作用。基于质谱的交联肽段解析能够提高互作蛋白鉴定的特异性、确定蛋白相互作用界面。然而,由于蛋白质样品和质谱数据解析过程的复杂性,对蛋白质化学交联后的交联产物进行高通量鉴定具有挑战性。在蛋白质样品进行质谱分析前,对交联肽段进行富集是提高鉴定效率的有效策略。
在本研究中,研究人员开发了一种基于化学基团氟磺酸的化学交联非天然氨基酸,即可富集的氟磺酸-L-酪氨酸(enrichable fluorosulfate-L-tyrosine, eFSY)。利用密码子扩展技术可以在蛋白质中特定位置插入具有潜在生物反应性的非天然氨基酸eFSY,eFSY中氟磺酸通过基于邻近触发反应诱导的硫-氟交换 (SuFEx) 点击反应与相互作用蛋白中的酪氨酸、组氨酸或赖氨酸发生共价交联。eFSY携带的炔基基团可以通过铜催化叠氮化物-炔环加成(CuAAC)点击化学反应链接生物素,随后就能实现交联肽段的富集,从而提升鉴定交联肽段的效率。此外,该研究发现氟磺酸基团介导的交联产物在质谱中的混合性碎裂规律,其与组氨酸及赖氨酸交联产生的磺酸酰胺键会在质谱中发生断裂,与酪氨酸交联后形成的磺酸酰胺键却不会断裂。为更好地应用该规律,该研究进一步开发了交联鉴定软件AixUaa。AixUaa可同时兼容并区分碎裂与不可碎裂两种模式,实现了交联肽段及位点的精确匹配,提升了交联肽段的鉴定数量。应用此流程,研究人员分别在大肠杆菌及哺乳动物活细胞中系统性地鉴定了硫氧还蛋白 1 (Trx1) 和硒蛋白 M (SELM)的直接相互作用蛋白组,验证了该方法的有效性。
总的来说,本研究开发的基于氟磺酸基团的可富集化学交联非天然氨基酸eFSY及交联鉴定软件AixUaa显著提升了在活细胞中鉴定相互作用蛋白中化学交联肽段的效率,克服了以往化学交联剂在鉴定蛋白质相互作用蛋白组的一些不足,有望应用于更广泛的蛋白质相互作用研究。刘丹丹、丁文龙、程劲韬、韦秋实为本论文的共同第一作者,杨兵、唐士兵和刘超为共同通讯作者。该研究获得了国家自然科学基金、国家重点研发计划、浙江省自然科学基金和广州健康院自主部署基础研究项目等项目的资助。
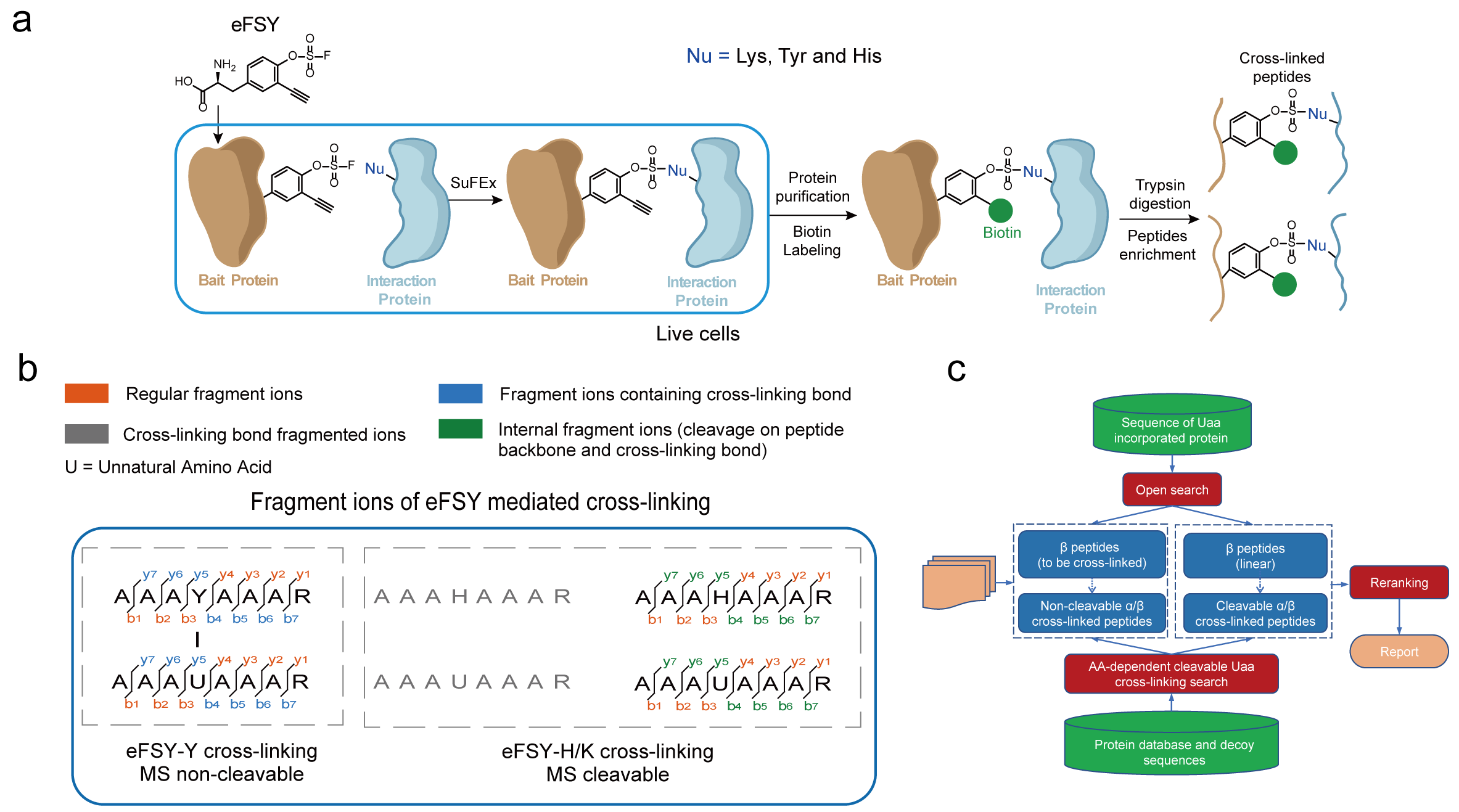
图1 新型含氟磺酸基团的可富集化学交联剂eFSY研究蛋白质相互作用时,鉴定交联肽段的流程图(a),交联肽段的碎裂规律(b)和交联鉴定软件AixUaa的开发流程(c)
附件下载:

