

发布时间:2024-06-19
近日,中国科学院广州生物医药与健康研究院(以下简称“广州健康院”)、广州国家实验室等单位联合在在学术期刊Nature communications上发表题为“Cryo-EM structures of Thogoto virus polymerase reveal unique RNA transcription and replication mechanisms among orthomyxoviruses” (Thogoto病毒聚合酶的冷冻电镜结构揭示了正粘病毒中独特的RNA转录和复制机制)的研究论文。
RNA的转录和复制是RNA病毒生命周期中至关重要的步骤。然而,这些过程受到宿主细胞的严格监控。例如,天然免疫相关RNA受体RIG-I能够识别病毒产生的没有cap-1结构的RNA,从而诱导细胞进入抗病毒状态。流感病毒是一类重要的呼吸道病原,它们长期以来是正黏病毒家族重要的代表。流感病毒的RNA聚合酶具有帽子抢夺(cap-snatching)活性,通过其帽子结合域(cap- binding domain)和核酸内切酶结构域(endo-nuclease domain)活性掠夺宿主mRNA5'端具有帽子结构的10-14 核苷酸长的寡聚核苷酸片段,作为引物来启动病毒mRNA合成。这种机制使流感病毒mRNA与宿主mRNA难以区分,从而帮助流感病毒抑制诱导宿主的免疫反应。此外,最近的研究表明,宿主因子ANP32对流感病毒的RNA合成至关重要,决定了病毒的宿主范围和感染能力,ANP32与流感病毒聚合酶的不兼容构成了流感病毒跨种传播的主要障碍之一。
Thogotovirus是正粘病毒家族中的一个重要的属。其成员以多种蜱虫为载体,有证据显示该属病毒能够较为高效地跨种感染多种哺乳动物。近年来多有Thogotovirus属病毒感染人类并导致死亡的报道。有研究表明,Thogotovirus属最早发现的成员 - Thogoto 病毒(Thogoto virus, THOV)转录的mRNA虽然具有帽子结构但缺少流感病毒中由帽子抢夺机制引入的10-14 核苷酸长的异源5'序列,这使得其RNA转录机制存在谜团。
在该研究中,通过单颗粒冷冻电镜技术,研究人员捕获了THOV 聚合酶在RNA合成过程中的十个不同的构象。这些结构重现了THOV RNA聚合酶在RNA转录和复制过程中的结构细节与多样的构象变化。重要的是,这些结构显示THOV聚合酶可以分别以有帽和无帽的二核苷酸引物启动RNA转录和复制。结合THOV聚合酶的帽子结合和核酸内切酶结构域没有活性的现象,研究发现提示,THOV聚合酶的帽子抢夺机制可能是非工作的,THOV可能利用细胞产生的有帽二核苷酸作为引物启动mRNA的转录合成。这些发现与流感病毒聚合酶帽子抢夺机制依赖的mRNA转录机制形成了鲜明对比。
正黏病毒聚合酶也需要合成无帽的RNA产物进行病毒RNA基因组的复制。宿主因子酸性核蛋白-ANP32已被证明在流感病毒的RNA复制过程中介导聚合酶形成一种非对称聚合酶二聚体,其中一个聚合酶用于合成产物RNA,而另一个聚合酶用于接收产物RNA。因此ANP32对流感的RNA复制过程至关重要。该研究却发现,THOV聚合酶仅进行产物RNA合成便能诱导聚合酶构象改变形成不对称二聚体,不需任何宿主因子的介导。这也与流感病毒聚合酶的RNA合成机制形成鲜明对比。通过系列生化和细胞实验,研究人员确认了,与流感病毒不同,THOV聚合酶的RNA合成在人细胞中对宿主因子ANP32A/B/E的依赖性很弱,可能是其能够较为高效地跨种感染多种哺乳动物的原因之一。
本研究从结构、生化和细胞层面,展示了THOV聚合酶在RNA合成和宿主因子利用方面相对于流感病毒的独特性。其对宿主因子ANP32的弱依赖性一定程度地解释了Thogotovirus属较广的感染谱,推进了对流感病毒等正黏病毒跨种传播分子机制的理解。研究扩展了现有的主要从流感病毒研究中建立的正粘病毒RNA合成机制,有助于归纳这类重要病毒的RNA合成共性机制,为后续广谱抗病毒药物的开发提供信息。
广州健康院熊晓犁研究员和广州国家实验室陈新文研究员为本文的共同通讯作者。广州健康院助理研究员薛璐博士和科研助理常添彩为论文的共同第一作者。研究获得广州健康院何俊研究员与鲍习琛研究员团队、中国科学院武汉病毒研究所龚鹏研究员团队、中国农业科学院哈尔滨兽医研究所王晓钧研究员团队等的鼎力合作与支持。该研究成果得到了国家重点研发计划、国家自然科学基金、广东省自然科学基金等项目的资助。
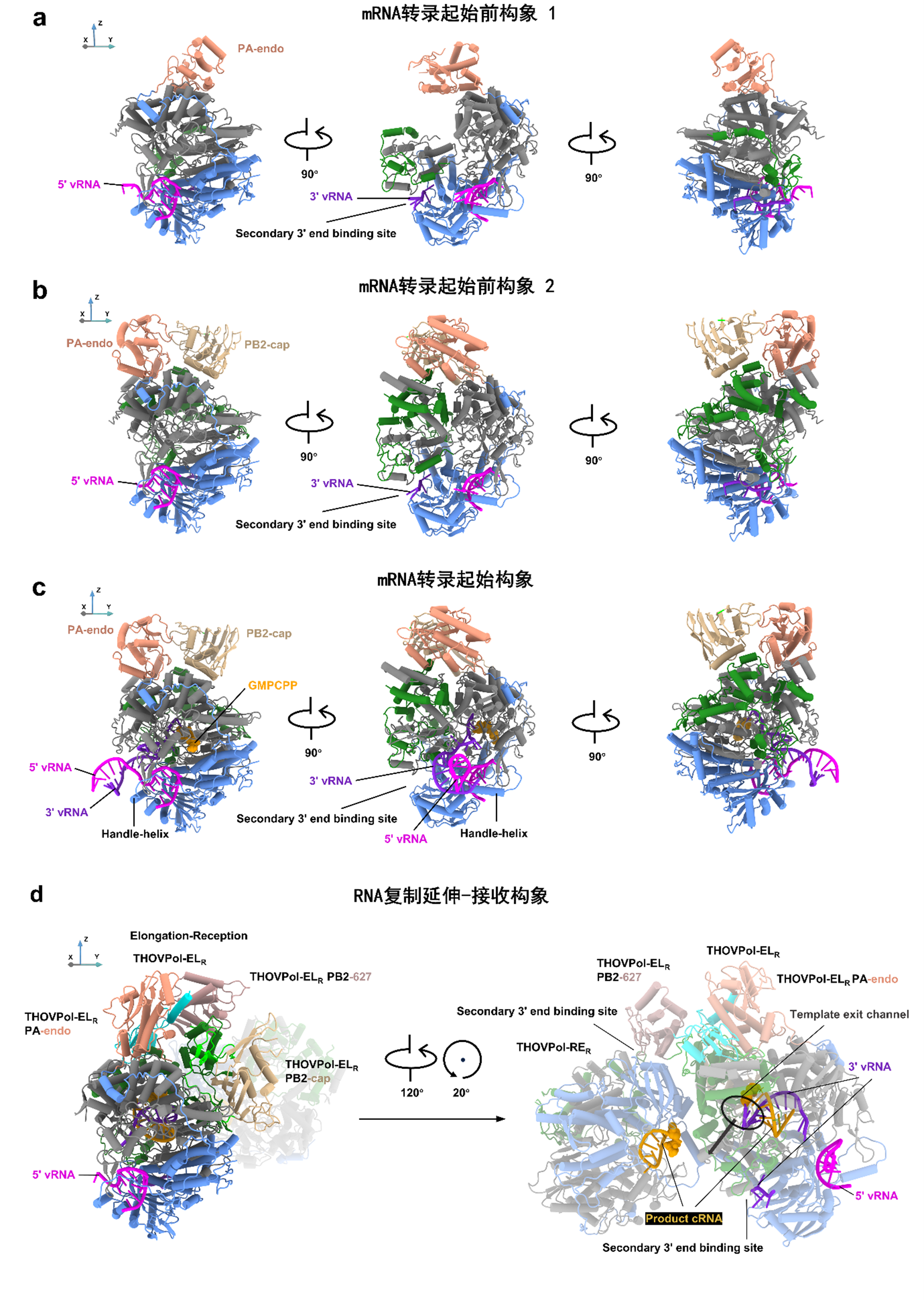
图1 THOV 聚合酶在RNA合成过程中呈现不同的构象
附件下载:

