

发布时间:2024-03-18
近日,中国科学院广州生物医药与健康研究院潘光锦课题组在Molecular Therapy- Methods & Clinical Development期刊发表了题为“Large-scale generation of IL-12 secreting macrophages from human pluripotent stem cells for cancer therapy”的文章。该研究提供了一种大规模生产用于实体瘤治疗的基因工程化巨噬细胞(GEMs)策略,并开发了一种功能增强型抗肿瘤GEMs,为GEMs的研发和应用提供了新的思路。
巨噬细胞可以被募集并驻留在肿瘤微环境(TME)中,在肿瘤发生过程中发挥重要作用。与T细胞、NK细胞等其他免疫细胞相比,巨噬细胞具有更好的肿瘤浸润能力,近年来其在实体瘤治疗中引起广泛的关注。TME存在多种免疫抑制机制,因此,GEMs已成为调节TME,治疗癌症的一种新型策略,旨在改善TME免疫环境。然而,巨噬细胞来源受限和基因修饰操作难等问题限制了巨噬细胞疗法广泛应用。因此,开发更有效的方法来克服这些限制对于GEMs治疗实体瘤至关重要。
该研究利用人多能干细胞(hPSCs)定向体外诱导分化产生成熟巨噬细胞(iMacs),从1个T150培养瓶106个hPSCs开始,1个月内可产生109个以上的成熟巨噬细胞,从而克服细胞来源的局限性。研究者利用hPSCs无限自我更新的特性,通过基因编辑将IL12的基因靶向整合到hPSCs的特异性安全位点上,随后通过上述分化体系产生稳定分泌IL12的GEMs(iMac_IL12)。iMacs及iMacs_IL12表达巨噬细胞相关标识物,具有典型的巨噬细胞特性,如吞噬和极化,在转录组水平与人外周血单核细胞来源的巨噬细胞相似。白细胞介素12(IL12)通过刺激NK细胞和T细胞来促进免疫,具有改善TME的极大潜力。但是IL12的半衰期短,且系统给药副作用较大。研究者发现通过静脉移植,iMacs_IL12可以在小鼠体内被招募并稳定驻留在实体瘤组织中,降低其副作用。
接下来,研究者发现iMacs_IL12可以诱导PBMCs产生大量IFN-γ以增强免疫。在体外及体内实验中,iMacs_IL12对CD8+T细胞的维持、增殖和激活均具有积极作用,并且可以抑制T细胞的耗竭。除此之外,iMac_IL12显著促进T细胞对宫颈癌、神经胶质瘤和肺癌等肿瘤细胞系的杀伤。在小鼠CDX模型中,iMac_IL12联合T细胞可以显著抑制小鼠的肿瘤生长并延长生存周期,并在小鼠肿瘤转移模型中同样可以显著降低肿瘤负荷,延长生存周期,并减少肿瘤细胞向主要脏器转移。
综上,本研究分化的iMacs可以克服巨噬细胞产品临床应用面临的来源障碍,避免了巨噬细胞在基因编辑和病毒整合中的安全性和低效性等问题。该GEMs显示出T细胞依赖的强抗肿瘤作用,可以显著抑制肿瘤生长和系统性转移,提高癌症存活率。
中国科学院广州生物医药与健康研究院博士后康保强为该论文的第一作者,中国科学院广州生物医药与健康研究院潘光锦研究员、朱艳玲副研究员为该论文的通讯作者。该研究成果得到了国家重点研发计划、国家自然科学基金、广东省科技计划项目、广州市重点研发计划等项目的资助。
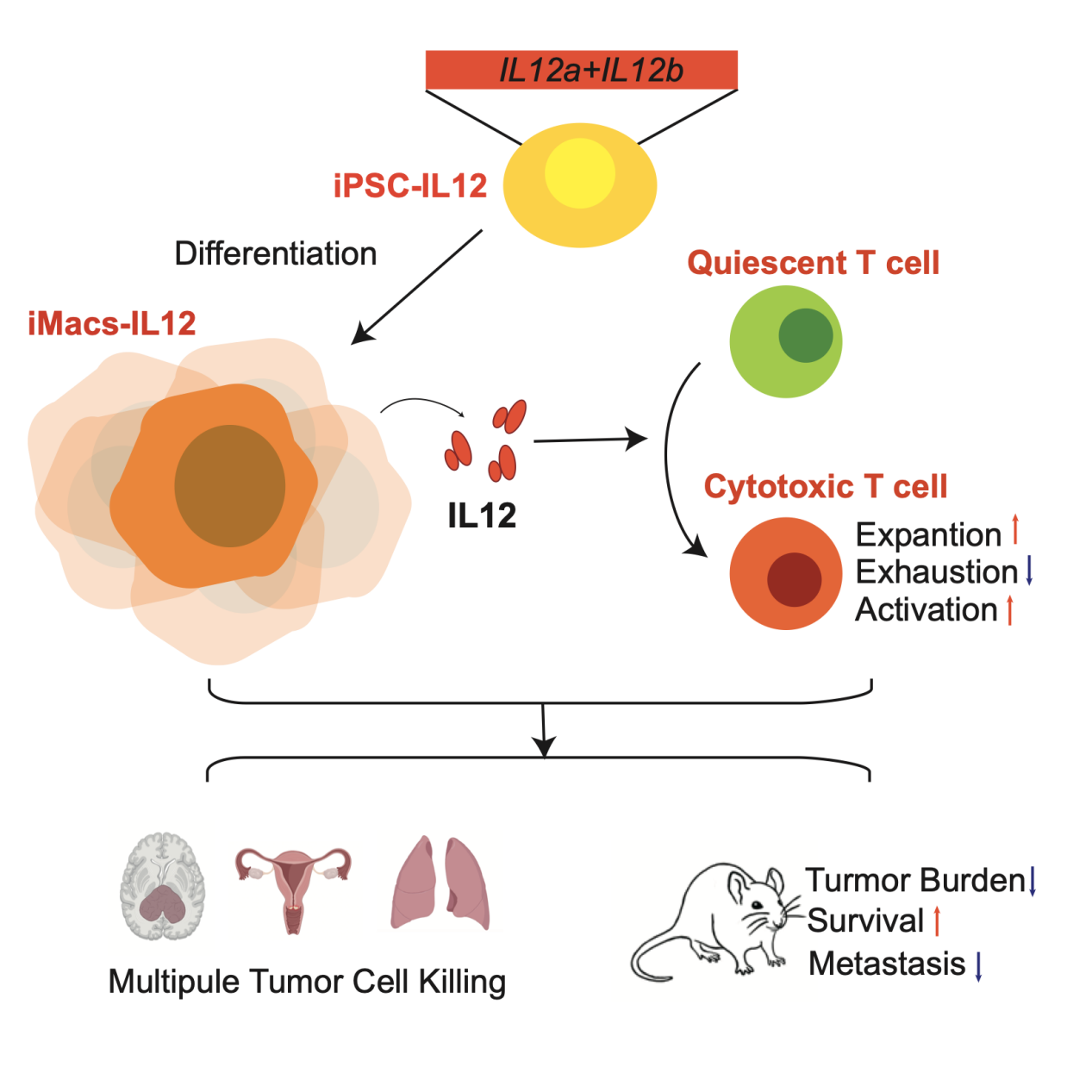
人多能干细胞来源的分泌IL12巨噬细胞抗肿瘤示意图
附件下载:

