

发布时间:2026-02-08
2026年1月20日,中国科学院广州生物医药与健康研究院细胞器与干细胞研究组在 Cell Discovery 期刊上发表了题为 “Post-transcriptional control of endogenous retroviruses by L1td1 suppresses totipotency acquisition in pluripotent stem cells” 的论文。该研究发现L1td1,作为多能干细胞中限制全能性获得的“守门者”, 它一旦“松懈”,细胞将有望回溯至生命最初的“全能”状态。L1td1通过招募CCR4-NOT复合物,特异性介导全能性相关基因及内源性逆转录病毒转录本的降解。本工作揭示了全能性和多能性转变过程中关键的转录后调控机制,首次阐明了源自逆转座子的蛋白在抑制内源病毒元件、调控细胞命运中的独特功能。
生命始于一个全能受精卵,随着发育进行,细胞潜能逐渐“锁定”,变为多能干细胞,失去发育成胎盘等组织的全能性。因此,全能性(Totipotency)与多能性(Pluripotency)的转换是早期胚胎发育的核心事件。在二细胞胚胎期,合子基因组激活(ZGA)伴随着内源性逆转录病毒MERVL及Zscan4等全能性基因的瞬时表达。随着早期发育到达囊胚期,这些基因被迅速沉默,细胞由全能性状态进入多能性状态。如何逆转这一过程、重新“解锁”细胞的全能状态,是再生医学和生命科学的终极梦想之一。全能性与多能性转换的转录及表观遗传调控机制已被深入研究,然而,亚细胞水平的转录后调控尤其是RNA降解,仍然是一个谜。
L1td1本身起源于基因组中一段可“跳跃”的病毒样遗传元件(LINE-1逆转录转座子),是哺乳动物基因组中唯一由LINE-1驯化而来的蛋白编码基因,在多能干细胞中高表达。团队利用小鼠和人的多能干细胞模型证实,L1td1的缺失使细胞中大量全能性基因被激活,表达特征显著类似于生命最初期的胚胎细胞(小鼠二细胞样、人八细胞样状态),这意味着细胞自发地向更原始、潜能更高的状态转变。L1td1蛋白能够特异性识别并结合一批与全能性相关的基因(如Zscan4家族)和一类“沉睡”在基因组中的古老病毒遗传片段(内源性逆转录病毒转座子,如MERVL-int, MT2_Mm),作为“守卫者”使用细胞内的“降解武器”(CCR4-NOT复合物),将这些维持全能性所必需的RNA分子快速降解,从而将细胞“锁”在多能状态。重要的是,研究还发现“守卫者”L1td1还能抑制其进化上的“祖先”LINE-1 RNA,提示其具有广泛抑制逆转录转座子的保守功能。
综上,该研究首次揭示了L1td1作为连接转座子沉默与细胞命运决定的关键枢纽,解析了驯化转座子蛋白通过CCR4-NOT通路调控全能性的新机制。该发现不仅深化了对早期胚胎发育中RNA动态调控、基因组稳定与进化博弈的理解,也为在再生医学中获取全能性细胞、实现异种器官再生提供了新的理论依据。
本研究获国家重点研发项目、中国科学院、国家自然科学基金、中国科学院青年创新促进会、广东省和广州市的经费支持。刘兴国研究员和邬毅副研究员为该论文共同通讯作者。邬毅、刘阳、黄奕乐为该论文并列第一作者。
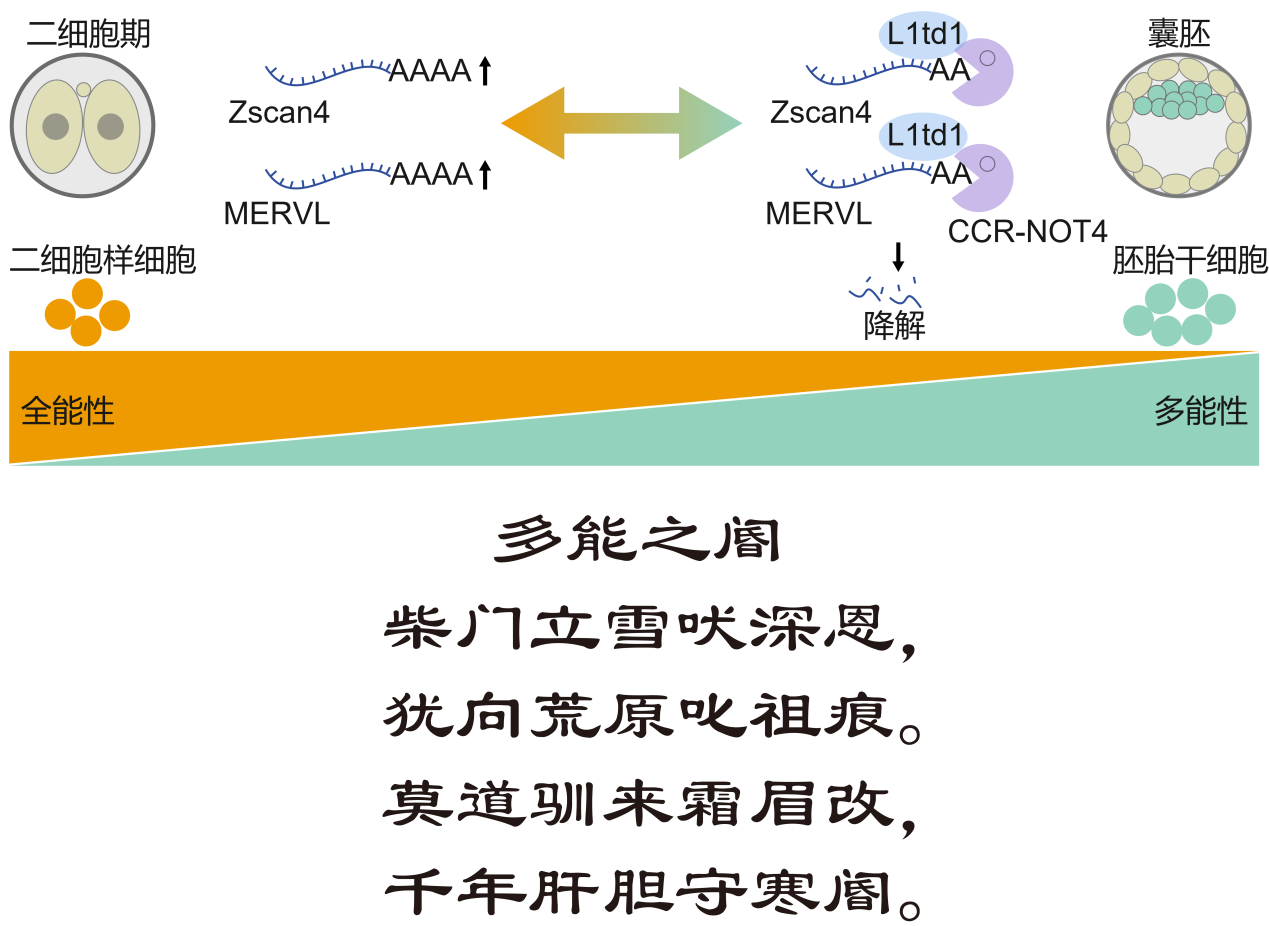
图注:L1td1由逆转录转座子在进化中驯化为蛋白质,反过来抑制其“祖先”元件的活动,而担任多能性的“守卫者”。L1td1宛如一只被人类驯化的忠诚猎犬,回身斥退荒原上的狼群祖先,正是“柴门立雪吠深恩,犹向荒原叱祖痕”;而其忠诚守护多能性“大门”的坚定职责,则恰如“莫道驯来霜眉改,千年肝胆守寒阍”。——来自刘兴国研究员的创意
附件下载:



