

发布时间:2025-07-23
2025年7月15日,中国科学院广州生物医药与健康研究院彭广敦课题组和广州国家实验室索生宝课题组合作,在Nature Communications上发表了题为High-resolution mapping of single cells in spatial context的研究论文。
细胞是生命的基本结构和功能单元,其活动不仅受胞内基因网络调控,还受到胞外微环境和细胞间通讯的影响。单细胞转录组测序技术为解析细胞异质性带来了革命性突破,但这一技术在细胞捕获过程中丢失了空间位置信息,严重限制了我们对细胞命运决定和调控机制的深入理解。
近年来,空间转录组技术迅速发展,成为揭示组织微环境中细胞状态与相互作用的重要工具。然而,现有技术在细胞尺度的分辨率和全转录本覆盖度方面仍面临挑战,亟需计算方法对单细胞数据进行精准的空间重建。
针对这一问题,研究团队提出了CMAP(Cellular Mapping of Attributes with Position)计算模型,通过整合单细胞和空间转录组数据,采用“分治”策略,实现大规模单细胞向空间位置的高精度映射。

CMAP借鉴“地图导航”式的搜索策略,逐步将细胞精准定位于组织空间中(图1):
1. DomainDivision:通过提取空间数据的粗粒度特征,将细胞初步分配至大的空间区域;
2. OptimalSpot:在区域内搜索与该细胞表达特征最匹配的空间样本点;
3. PreciseLocation:进一步结合该样本点及其邻域的空间组织特征,利用弹簧平衡态模型,推断细胞的精确坐标。
这一分层映射策略使得CMAP能够在保证计算效率的同时,实现单细胞分辨率的空间表达图谱重构。
为系统评估CMAP的预测性能,CMAP在多组模拟数据和高分辨率Xenium空间数据上进行测试。通过比较不同方法的预测精度、细胞类型占比及重构的空间基因表达模式,结果表明CMAP在预测准确性和重构效果方面均优于现有方法CellTrek和CytoSPACE。特别是通过弹簧平衡态模型优化,CMAP能够提供单细胞级空间坐标,突破了大多数方法仍停留在spot水平上的局限,实现真正的单细胞空间重构。此外,CMAP在不同数据质量和不同技术来源的多种应用场景中表现出兼容性与鲁棒性,能够有效解决特定细胞的空间定位和非匹配细胞的过滤问题,而CellTrek和CytoSPACE则在此类场景中存在明显不足。在真实生物学问题中,CMAP在彭广敦课题组发表的Geo-seq数据以及小鼠13.5天胚胎空间转录组数据中均展示了优异的空间位置特异定位能力,也揭示了胚胎内皮细胞的组织异质性。此外,CMAP还成功重构了肿瘤免疫微环境中的三级淋巴结构(Tertiary lymphoid structures,TLS),揭示了T/B细胞在空间上共定位和相互作用,并基于空间坐标实现了高分辨率的细胞互作分析。
综上所述,本研究构建了单细胞空间位置推断模型CMAP,建立了“单细胞-空间-功能”的多维解析框架,推动了单细胞转录组与空间组学的深度融合,为疾病机制解析和精准医学发展提供了新的研究思路。
中国科学院广州生物医药与健康研究院彭广敦研究员和广州国家实验室索生宝研究员为该论文共同通讯作者,广州健康院博士研究生柯今灿为论文第一作者。
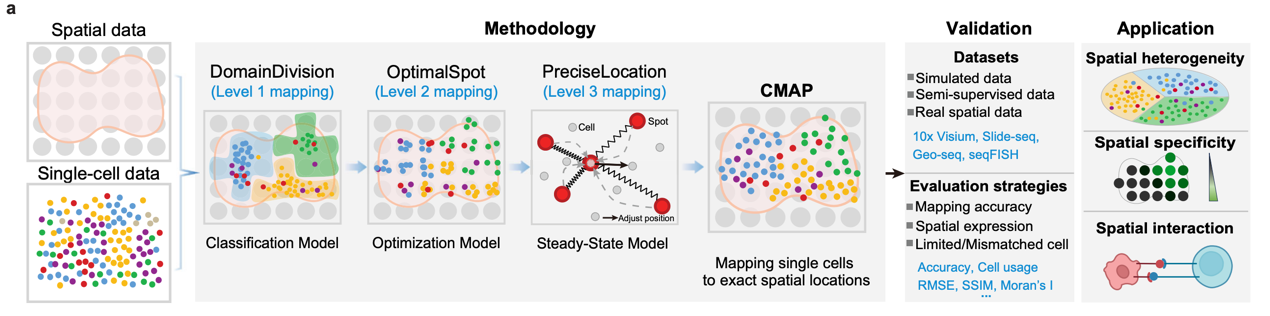
图1. CMAP方法的框架设计
附件下载:



