

发布时间:2024-06-25
中国科学院广州生物医药与健康研究院研究团队揭示了分选转运蛋白SNX25通过氧化还原依赖的方式调控内涵体GPCR-G蛋白信号转导的分子机制。相关研究以“Redox-Modulated SNX25 as a Novel Regulator of GPCR-G Protein Signaling from Endosomes”为题在线发表于氧化还原领域权威期刊Redox Biology.
最近十几年来,越来越多的研究表明,GPCR与G蛋白偶联的信号转导不仅可以发生在细胞质膜上,也可以发生在细胞内的内涵体上。内涵体GPCR-G蛋白信号转导与癌症、骨骼发育、神经兴奋和糖尿病等生理和病理过程密切相关。RGS蛋白(G蛋白信号转导调节因子)能激活Gα亚基的GTP水解酶活性,促进Gα亚基的失活,从而终止G蛋白信号转导。 RGS蛋白对质膜上GPCR-G蛋白信号转导的调控作用被广泛报道。但内涵体上GPCR-G蛋白信号转导的调控机制,尤其是内涵体上G蛋白信号终止的分子机制,仍有待进一步研究。
研究团队利用免疫沉淀-质谱联用技术和荧光共定位等实验方法,发现SNX25的PX结构域能结合一些经典的RGS蛋白,包括RGS2、RGS4、RGS8和RGS17。通过结构生物学和细胞生物学实验,研究团队发现SNX25与RGS蛋白的相互作用主要依赖SNX25-PX结构域中C566与RGS蛋白N端半胱氨酸形成的分子间二硫键,且该相互作用受氧化还原的调控。通过荧光共定位实验,团队进一步发现PXA和PXC结构域可以介导SNX25靶向内涵体。通过招募经典RGS蛋白到内涵体,SNX25可以促进内涵体上Gαi/q蛋白的失活,最终抑制内涵体上GPCR-Gi/q偶联的信号转导(图1)。
此外,团队还发现SNX25/RGS复合物不仅可以结合激活型Gi/q;(GTP结合态),也可以结合失活型Gi/q;(GDP结合态)。通过将失活型Gi/q;募集到内涵体上, SNX25/RGS蛋白复合物还可以抑制质膜上GPCR- Gi/q信号转导。
广州健康院博士后张玉龙和硕士研究生余致君为共同第一作者,徐进新研究员和刘劲松客座研究员为共同通讯作者。该研究获得了国家自然科学基金面上项目和呼吸疾病全国重点实验室自主课题等项目的支持。
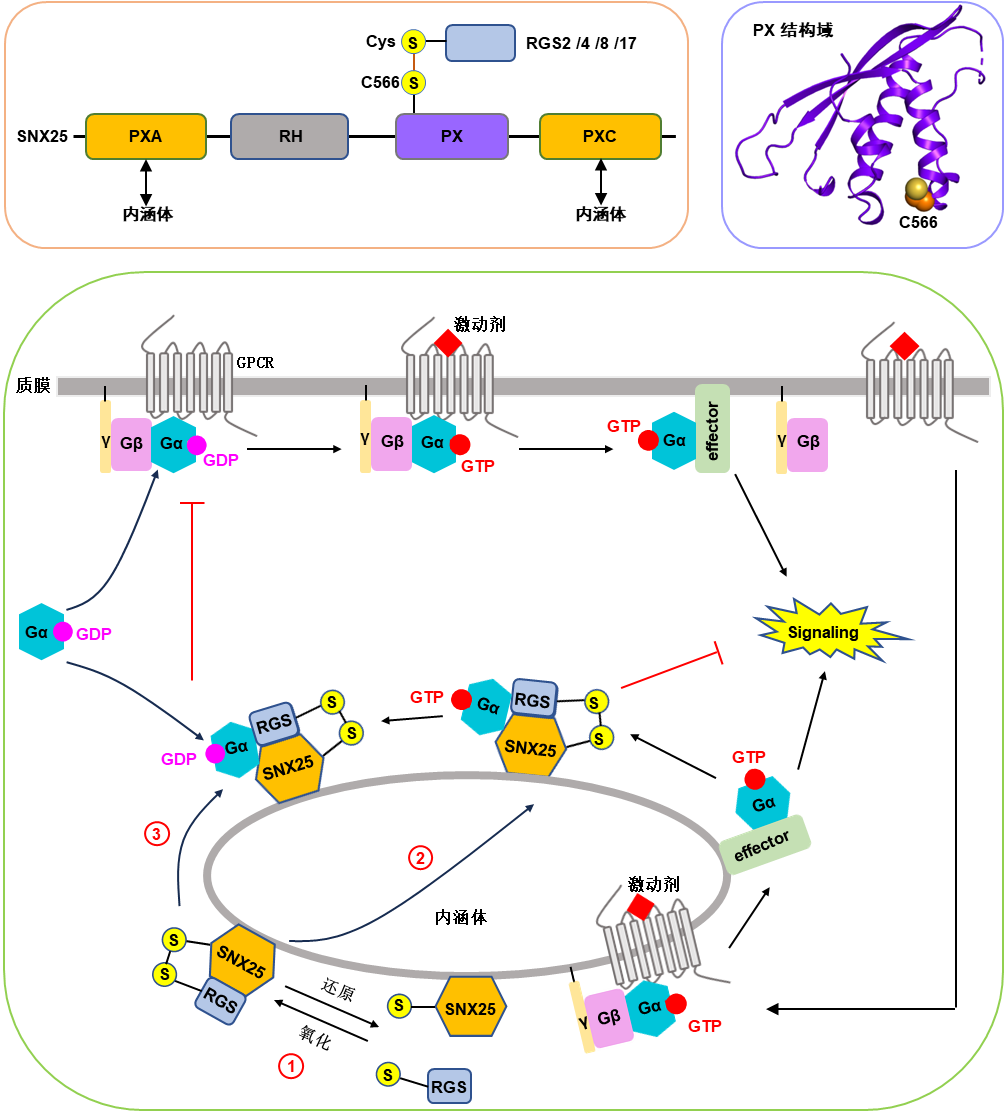
图1 SNX25调控GPCR-G蛋白信号转导的分子机制
附件下载:



