

发布时间:2019-02-26来源:供稿:感染与免疫中心 张天宇、刘洋、高亚敏
近日,中科院广州生物医药与健康研究院、呼吸疾病国家重点实验室结核病研究室张天宇团队与广州市胸科医院刘健雄团队等合作揭示了抗结核新药TB47的作用机制,初步阐明了其对不同分枝杆菌的作用效果存在较大差异的原因。研究还证明TB47的药代动力学常数非常理想,初步毒理学实验证明其毒性很低,有望成为治疗由布鲁利坏死分枝杆菌(Mycobacterium ulcerans, Mu)引起的布鲁利坏死病(Buruli ulcer,BU)的特效药。
现有抗分枝杆菌疗法普遍存在使用周期长和毒性高的问题,并且由于耐药菌不断出现,临床疗效越来越差。临床上急需抗分枝杆菌的新药,特别是能克服耐药菌的具有新机制的药物。张天宇团队与本单位药化团队联合研发抗结核候选药物TB47已获得中国和美国专利授权并进入了正式的临床前研究(http://www.newtbdrugs.org/pipeline/discovery)。在体外和体内的实验研究中,团队发现TB47对Mtb主要表现为抑菌活性,但是与多种药物具有体内外协同、相加作用。
在和澳大利亚联邦科学与工业研究组织进行的一项国际合作项目中,团队检测了多种化合物对Mu的活性,结果发现TB47对Mu表现出了惊人的杀菌活性。BU是由Mu感染造成,其目前是除结核、麻风病以外的第三大分枝杆菌疾病。在1项小鼠模型研究中,研究人员发现仅仅使用低剂量的TB47治疗了5天,小鼠感染的发光菌的发光值已经降低至背景并且脚部病理肿胀已经显著缓解甚至消失,而目前WHO推荐的两种药物联合使用(其中一种需要注射且毒副作用很高)治疗4-5周的小鼠仍然可以检测到活体发光值并且肿胀也仍然十分明显。进一步复发研究表明:TB47单独使用25 mg/kg口服治疗5天的效果与标准疗法治疗5周的效果相当。
为揭示TB47的作用机制,团队筛选对TB47耐药的Mtb自发突变株,然而每次筛选都没获得真正具有突变的耐药菌株。海分枝杆菌和Mu的基因组相似性非常高,并且生长更快。因此团队使用海分枝杆菌和Mu进行耐药菌株筛选,并成功获得了耐药的突变株。这些突变株菌在qcrB基因上存在单碱基突变。QcrB参与的是分枝杆菌中的电子传递链,然而在分枝杆菌中还存在非QcrB参与的互补通路Cyt-bds。因此,Cyt-bds通路很可能会保护分枝杆菌免受TB47的杀伤作用。
进一步研究证明了Cyt-bds通路在不同的分枝杆菌中的活性不同。如在耻垢分枝杆菌中的活性足以保护耻垢分枝杆菌免受TB47作用;在Mtb中较弱,TB47产生了抑菌活性;在Mu中活性极低,这就使QcrB参与的通路成为了Mu的“致命弱点”,靶向QcrB的TB47也就产生了惊人的杀菌活性。有趣的是,团队在进行生物信息学分析时,发现在麻风分枝杆菌中甚至没有与Mtb的Cyt-bds通路相关酶的同源蛋白。
该发现也启发,一些代谢通路或酶在不同分枝杆菌中存在显著地活性差异。因此在开发抗结核新药,需要直接使用Mtb。类似的案例有:抗结核一线药物吡嗪酰胺,其只对Mtb有活性,对与Mtb高度相似的牛结核分枝杆菌没有活性。该研究同样也启示,如果可以将寻找到Cyt-bds通路的抑制剂,将该抑制剂和TB47联合使用,那么对于Cyt-bds通路较强的菌株,如Mtb,同样可能会产生惊人的疗效。根据这一发现,我们在进行一系列的新合作研究。
研究成果近期发表在Nature Communications。与此同时,Nature Research Microbiology Community邀请张天宇研究员撰写的“The Achilles' Heel Targeted by TB47 Is Protected in Select Mycobacteria”在“Behind the Paper”频道(https://go.nature.com/2Lp7wC5)发表。本文的共同第一作者为中科院与安徽大学联合培养的刘洋同学和中国科学院大学的高亚敏同学。相关工作得到了国家重大新药创制专项、国家传染病重大专项、中国科学院项目、广州市健康医疗协同创新重大专项的经费支持。
论文链接:https://rdcu.be/bjouO
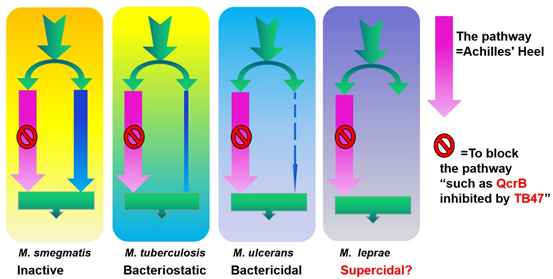
分枝杆菌“致命弱点”示意图
附件下载:



