

发布时间:2017-08-28来源:供稿:干细胞所 赖允鑫
8月3日,白血病领域权威杂志Leukemia在线发表了中国科学院广州生物医药与健康研究院李鹏课题组的最新研究成果“Toll-like receptor 2 costimulation potentiates the antitumor efficacy of CAR T Cells”。该研究构建了包含TLR2共刺激信号的第三代嵌合抗原受体(Chimeric antigen receptor,CAR)分子,并证明了TLR2共刺激信号提高了CAR T细胞杀伤肿瘤的功能。这一研究为天然免疫和适应性免疫在CAR T细胞治疗中的联合效应提供了理论基础,并开拓了CAR分子设计的新思路。该成果的基础研究部分是博士研究生赖允鑫、魏新茹等在导师李鹏研究员指导下完成的,临床试验部分则是由广东省人民医院血液科杜欣主任和翁建宇主任率领的团队完成的。
嵌合抗原受体(Chimeric antigen receptor,CAR)T细胞治疗是近年来肿瘤免疫治疗领域最具影响力的疗法,其中针对CD19的CAR T已经在临床试验中获得很好的疗效。CAR分子赋予T细胞特异性识别杀伤肿瘤细胞的功能,该膜分子胞外有识别抗原的ScFv段,胞内含有传递活化T细胞和介导T细胞杀伤功能的结构域。CAR分子的设计对CAR T的最终疗效至关重要。其中共刺激分子如CD28,41-BB等为CAR T细胞的功能提供必要的辅助。然而CAR T细胞疗法在针对其他抗原或实体瘤中作用不明显,因此CAR分子的设计还需要新的共刺激分子,以增强并维持CAR T细胞对血液瘤和实体瘤的功能。
天然免疫和适应性免疫的相互作用是人体免疫系统发挥功能的重要模式。为了在CAR分子中借鉴和模拟这一模式,该研究将天然免疫系统的重要受体TLR2的胞内信号传递结构域引入到CAR分子中,构建了包含TLR2的CAR分子,1928zT2和m28zT2,分别针对表达CD19的B细胞白血病和表达mesothelin的实体瘤。体外结果表明,TLR2的加入促进了CAR T细胞针对白血病细胞和实体瘤细胞的杀伤,以及抗原诱导的细胞因子IL2,IFN-g和GM-CSF的分泌。通过免疫缺陷小鼠构建的人源化异种移植(PDX)模型的体内实验表明,带TLR2的1928zT2 T细胞比1928z T细胞具有更强的杀伤白血病细胞作用和分泌细胞因子功能,并促进B细胞白血病PDX小鼠的存活;同样的是,带TLR2的m28zT2 T细胞也比m28z T细胞具有更强的体内杀伤肺癌细胞系的功能。机制研究中,该研究应用RNA-seq比较了TLR2加入后CAR T细胞在抗原刺激或不刺激的情况下基因表达情况,结果表明TLR2能上调的基因与细胞黏附与迁移有关,体外细胞侵袭实验也表明TLR2能增强CAR T细胞的迁移能力。CAR T细胞的潜在毒性是临床应用的主要障碍之一,TLR2的加入增强了CAR T的杀伤功能,但也可能提高CAR T细胞的毒性。因此,为了验证含TLR2的1928zT2 T细胞在人体内是否安全有效,广州生物院李鹏团队与广东省人民医院血液科杜欣团队合作在一名B细胞急性白血病患者身上进行了临床试验:将5e4/kg低剂量的1928zT2 T细胞回输患者后,患者迅速产生了应答,并在20天左右获得了白血病细胞的清除,在51天时检测结果显示为完全缓解。因此,临床结果表明TLR2加入CAR分子这一设计是安全有效的。
该项目得到国家自然科学基金、科技部重点科技计划、广东省及广州市科技计划等的支持。
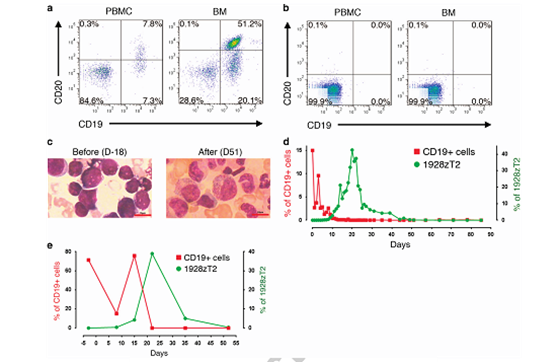
含TLR2的1928zT2 T细胞使急性B淋巴细胞白血病患者获得完全缓解
附件下载:



