

发布时间:2011-10-10



1.多能性细胞的研究历史
人类是地球上最好奇的一种动物,当第一个孩子对着自己掉下的牙齿发呆,琢磨为什么玫瑰花可以长出新枝而自己的牙齿埋进土里却什么也长不出来开始,人类就已经走上了探索多能性之路了。
我们都知道,一个人的个体发育是由受精卵开始的。由妈妈那里来的卵子和从爸爸那里来的精子结合后,形成一个受精卵,专业上讲就是合子。受精卵一分二、二分四,以几何级数倍增,并且不断的分化、迁移,最终形成一个新的个体。
胚胎发育从受精卵开始,经历2细胞、4细胞、8细胞、16细胞、桑椹胚、囊胚和孵化胚等阶段,随后发生附植,经原肠化作用形成3个胚层。基本上讲,凡是取自早于囊胚期内细胞团之前的胚胎的干细胞以及与它们结构、性质、功能一样的细胞我们都称它们为胚胎干细胞。胚胎干细胞是研究多能性的最理想的材料,因为它们是除了受精卵以外分化能力最强的一类细胞。事实上,除了胎盘以外,严格意义上的胚胎干细胞可以分化成动物体(实际上是小鼠)的所有种类的细胞、组织和器官。
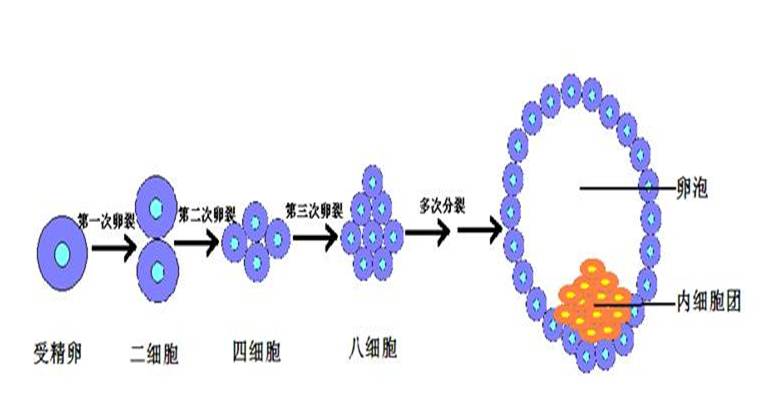
对于多能性的研究是一个很长的故事,现在让我们从头说起。
·不是胚胎干细胞的胚胎干细胞——胚胎癌细胞
人类是那么想知道多能性的秘密,以至于早在19世纪,就有人提出来通过研究胚胎癌细胞来探索多能性的秘密。
为什么呢?因为胚胎实在是太小、太难得了,如果你要研究胚胎干细胞的话,必需得到非常早期的细胞,而这样的细胞是很难从组织里分离出来的,就算分离出来也很难让它们在人工的条件下生存下来,更不要说保持它们的自我更新和分化的能力了。
所以,在很早以前就有人把主意打到了胚胎癌细胞的头上。胚胎癌细胞是一类发生于原始生殖细胞的未分化癌,由于它的特殊的生物学特点,人们认为它的形成在一定程度上反映了胚胎的发育,而胚胎癌细胞可能与胚胎早期未分化的干细胞相类似。但是这种肿瘤在人或动物体内的发病率是非常低的,这限制了胚胎癌细胞的研究,使得早期的动物多能性的研究举步维艰。
早在1956年巴里·皮尔斯和他的同事们就分离出来了人的胚胎癌细胞系,但是不幸的是他们所建立的细胞系以及此后其他科学家建立的人的胚胎癌的细胞系都没有继续分化的能力。
但是科学家们是不会轻易被困难打败的,1958年,勒罗伊·史蒂文斯和他的同事们把小鼠早期胚胎移植到129品系小鼠的卵巢或肾脏被膜下,从而得到胚胎癌细胞。这是第一株被证明有类似于干细胞功能的肿瘤细胞。1964年克兰斯密斯和皮尔斯又证明单个的胚胎癌细胞具有自我更新和多向分化的功能。至此,人类终于有了可供研究多能性的细胞系,虽然其实这不是真正意义上的胚胎干细胞,而更像是一种肿瘤干细胞。
·生殖系干细胞
另外还有一类多能性干细胞叫做生殖系干细胞,其实分为两类,其中一类也来源于胚胎,但不是来源于严格意义上的胚胎干细胞的产生时期――内细胞团,而是来源于之后的原始生殖嵴。这种细胞是选取在胚胎发育过程中的将要发育成生殖器官的那一部分组织加以分离得到的:以小鼠为例,胚胎干细胞应该是来源于受精后2-3天的胚胎,而生殖系干细胞则来源于8.5天到10天的胚胎;相对于人体而言则是5-10周的早期胚胎。这种细胞被称为原始生殖细胞。
刚分离出来的原始生殖细胞只能维持很短的一段时间,但由它建立起来的胚胎生殖细胞系则具有与胚胎干细胞相似的生物学特性,比如都具有自我更新能力,都可以分化成三个胚层的细胞,都有完整的二倍体染色体等等胚胎干细胞的特点。但是,原始生殖细胞还有它自己的特点,比如,它非常的娇嫩,普通的小鼠的胚胎干细胞即可以在支持细胞(滋养层细胞)中生长,也可以不要支持细胞生长,但原始生殖细胞却不能没有支持细胞来给它做“保姆”;更重要的是,它在印迹基因上与胚胎干细胞有着明显的区别,以小鼠为例,9.5天的表达与体细胞一样的印迹基因,到了10.5天就成了生殖细胞的印迹基因表达模式。这是为什么呢?研究其中的机制对我们了解胚胎发育的过程至关重要。
我们为什么要研究生殖系干细胞呢?首先,多数生殖系干细胞都有着与胚胎干细胞类似的多能性,是研究多能性的较为理想的材料。但更重要的是,我们知道,几乎所有的胚胎都是从受精卵开始的,而受精卵的形成是需要来自父母双方的生殖细胞的,那么生殖细胞是如何结合而形成受精卵,继而形成胚胎的?生殖细胞无疑是研究这一过程的重要一步。还有,生殖系干细胞还可以被用来研究不育不孕症,为千千万万没有孩子的家庭造福。
小故事:
原始生殖细胞是由田纳西范德比尔特大学医学院的松井泰久和马里兰州的詹姆斯·雷斯尼克在1992年同时分别分离得到的。
有趣的是,这种同一种类型的细胞在两个不同的实验室在同一时间分别得到的现象在细胞生物学界比比皆是,比如小鼠的胚胎干细胞、人的胚胎干细胞以及人的诱导多能性干细胞等,发现原始生殖细胞的这两个实验室就分别是在1992年的9月和10月发表的文章。不知道这是历史的必然还是纯粹的巧合。
·胚胎干细胞
(1)小鼠
真正意义上的哺乳动物的胚胎干细胞其实是从小鼠的胚胎干细胞开始的。1981年7月9日,著名的《自然》杂志发表了英国剑桥大学的马丁·约翰·伊文思爵士和他的同事马修·库夫曼的一篇文章,报道他们建立的第一株小鼠的胚胎干细胞系。同年12月,美国加州大学的盖尔·马丁也在《美国科学院院报》上发表文章,报道了她所建立的小鼠胚胎干细胞系。
胚胎干细胞系的分离和建立是非常非常困难的。首先,小鼠的早期胚胎非常的小,事实上小鼠的子宫和卵巢在肉眼下基本上是看不到的,我们只能在放大镜(体视镜)下寻找它们的踪迹,然后用非常精密的手术器械剥离囊胚(一般是用专门仪器拉制的玻璃针)。一般一只小鼠会有几到十几个胚胎,把它们挑出来后放在专门的培养皿中培养,并不是每个胚胎都可以继续分裂生长的,也有的胚胎长着长着就自发的分化了。而“免疫手术法”因为要进行免疫操作,就更为困难一点了。
但是科学家们是不会被困难吓倒的,英国牛津大学的保罗·特萨教授甚至做了这样的实验:他分别用小鼠的合子(受精卵)、2细胞、4细胞、8细胞,一直到桑椹胚和囊胚阶段的胚胎建立胚胎干细胞系,比较它们的成功率以及所建立的细胞系的各种特性。这得有多大的毅力和耐性才能做到啊!
事实上,早期胚胎地显微操作是一个技术要求极高的高精度工种,在美国,一个技术精湛的显微操作技术人员的工资比一个原子核物理教授的工资都要高,而且还供不应求,每个技术人员都是他们实验室的“宝贝”,即使是在金融危机的时代也完全不用担心会“下岗”。
还有值得一提的是,马丁·约翰·伊文思爵士因为建立小鼠胚胎干细胞系、基因敲除小鼠和基因打靶上的杰出贡献,与马里奥·卡佩琪和奥利弗·史密斯共同分享了2007年的诺贝尔医学与生理学奖。事实上,基因敲除和基因打靶的基础都是小鼠胚胎干细胞系的建立,没有胚胎干细胞系的建立,其他的基因操作根本无从谈起。

马丁·约翰·伊文思爵士
马丁·约翰·伊文思爵士分离培养的小鼠胚胎干细胞
除了用自然孕育的小鼠胚胎分离胚胎干细胞外,其实现在更多的还是用核移植的方法来获取胚胎干细胞,就是把一个来源于体细胞的核取出来,移植进入一个小鼠的卵细胞中,经过体外培养和刺激,使其分裂发育成早期胚胎,再分离培养成为胚胎干细胞。这种方法比直接使用胚胎更为简单,成功率也高,更重要的是没有伦理道德争论,除了可以用在动物上,也可以用于人的胚胎干细胞的分离。
[延伸阅读] 女儿国是神话吗?
“孤雌生殖”,就是把雌性小鼠的卵母细胞拿出来经过各种不同的物理的、化学的刺激,使其激活,形成二倍的雌原核,继而发育成胚胎,而从这样的胚胎中也可以分离出来胚胎干细胞。而如果这样的胚胎继续发育下去,就会形成“没有父亲的小鼠”了。你看,女儿国并不是只在神话传说中才有的。
(2)人
人的胚胎干细胞的建立要晚得多。1998年11月6日的《科学》杂志发表了一篇名为“人类胚泡来源的胚胎干细胞系”的文章,介绍了第一株人类胚胎干细胞系的分离、培养和鉴定过程。这个工作是美国威斯康星大学的詹姆斯·亚历山大·汤姆森教授和他的同事们的研究成果,也是胚胎干细胞研究中划时代的一件大事。
詹姆斯·亚历山大·汤姆森是胚胎干细胞研究领域的大牛,在2007年也是他的实验室,与日本山中申弥的实验室同时得到了人类诱导多能性干细胞,这也是干细胞领域划时代性质的一件大事,2008年,他与山中申弥共同被美国《时代》杂志评选为影响世界的100位名人的第54位。不知道他会不会是下一位诺贝尔医学与生理学奖的获得者,让我们拭目以待。

詹姆斯·亚历山大·汤姆森教授
詹姆斯·亚历山大·汤姆森教授分离培养的人胚胎干细胞
汤姆森他们使用的是由捐献者在体外人工受精的受精卵(这些受精卵应该是做试管婴儿时废弃剩下的材料,由患者授权捐出),他们一共选取了36个冷冻或未经冷冻的受精卵,其中20个在特殊的培养基中发育成了胚泡。他们选取了其中的14个分离胚泡中的内细胞团,其中5个最终形成了胚胎干细胞系。
他们为自己的人类胚胎干细胞系制定了严格的定义:(1)必需来源于着床前或正在着床的早期胚胎;(2)可以长期增殖而不分化;(3)具有稳定的可以分化成三个胚层的能力。在他们的文章中,这些目的都达到了。
到目前为止,他们所分离得到的人类胚胎干细胞系在世界各地的实验室中得到了广泛的应用,是最经典的人类胚胎干细胞系。套句“大腕”里的话:如果一个研究人类胚胎干细胞的实验室如果用的不是来自于汤姆森实验室的H1或H9等细胞系,你简直就不好意思和人打招呼!
事实上,汤姆森实验室的胚胎干细胞研究是有着非常深厚的科研基础的,在人类胚胎干细胞之前,他们就分别在1995年和1996年首次分离鉴定了恒河猴和狨猴的胚胎干细胞,同时做了大量的胚胎干细胞自我更新及多能性机制方面的研究,所以由他们实验室首次分离鉴定出人类胚胎干细胞和人类诱导多能性干细胞一点儿也不奇怪。
·成长的故事——人与小鼠的胚胎干细胞的不同
到目前为止,研究最多的,还是人与小鼠的胚胎干细胞,但是实际上这两种干细胞还是有很大的区别的,这些区别在干细胞学界引起了巨大的旷日持久的争议,到目前为止还无法得出一个定论。
从经典的定义上来讲,胚胎干细胞必需是来自于囊胚期的内细胞团的细胞,但是人们发现这些细胞并不都是一致的,而是多种细胞的混合体。那么,我们很容易就可以想得到,从这些细胞出发,我们得到的它们的后代也不会是完全相同的,有的也许更幼稚一点,有的也许更成熟一点。
事实上也确实是如此,一个细胞系的细胞也许通过一定的实验条件的选择,可以达到一致,但是不同批次不同品系甚至不同物种的胚胎干细胞就会有很大的差别了。
拿人和小鼠的胚胎干细胞来讲吧,人的胚胎干细胞无论是在形态上还是在很多生物学特性上都更类似于小鼠的上皮胚胎干细胞,而人的生殖系干细胞却长得很像小鼠的胚胎干细胞。因为上皮层在胚胎发育中是晚于囊胚期的,所以人们一致倾向于认为人的所谓“胚胎干细胞”实际上比小鼠的要“成熟”。为了得到更为“幼稚”的人类的胚胎干细胞,人们做了各种各样的尝试,但到目前为止还没有什么得到定论的结果。毕竟,人和小鼠本来就是两种不同的物种,究竟是怎么发育和进化的,到目前为止还是一个谜。
但,科学的目的不就是揭示世界上的谜团的吗?
·诱导多能性干细胞
目前,胚胎干细胞研究中最热的一个方向其实是“诱导多能性干细胞”,就像干细胞界的“超女”和“快男”一样,2006年一炮而红,至今粉丝众多,短短4年,发表的文章就已经超过2500篇,真的可以说得上是炙手可热。在这个领域中国科学家也贡献颇多,可以说我们是和世界上的其他科学家站在同一个起跑线上,齐头并进。
简单的说,动物体的胚胎发育其实是一个程序化的过程,从受精卵开始,不断的分裂、增殖、分化,在什么时候什么位置表达什么蛋白都是设定好的,而这个设计图就藏在我们的DNA序列之中,生而有之。做为进化树上较为高等的哺乳动物,这个程序化的过程大部分是不可逆的,所以才有所谓的终末分化细胞。
但是,人们为了研究多能性的秘密,总是在想方设法地想要逆转这个过程。最初人们想出的办法就是核移植,把一个体细胞的核移入到一个去核的卵细胞中,让这个卵细胞分裂增殖,这就意味着重新启动了那个体细胞的发育程序,从而得到一个新个体,绵羊“多莉”就是这样来的。
但这并不能完全说明问题,因为我们只是拿一个细胞的一部分逆回到了原始的状态,而且还是通过把它和原始细胞融合才能得到。所以不能就此满足的科学家继续探索,终于在2006年日本的帅哥科学家山中申弥第一个做出了小鼠的诱导多能性干细胞,第二年又和美国的一个实验室同时做出了人的诱导多能性干细胞。
这种细胞就是通过实验室人工诱导的方法(最初是用病毒转基因的方法)来使已经终末分化的细胞重编程成为最为“幼稚”的胚胎干细胞。不需要卵细胞,只需要一些病毒、质粒和化合物,就可以把一个体细胞恢复成具有胚胎干细胞特性的细胞。神奇吧?
关于诱导多能性干细胞的具体研究我们将会在后面的章节进行专门的论述。
2.为什么要研究胚胎干细胞
·胚胎干细胞在再生医学中的重要作用
相对于目前已经大量用于临床的成体干细胞来讲,胚胎干细胞从长远来讲,在再生医学中具有更辉煌的前景。
这是由胚胎干细胞的两个特点决定的:首先,胚胎干细胞具有强大的自我更新和无限增殖的能力,这样就可以源源不断的提供用于修复的细胞;其次,胚胎干细胞还有强大的分化能力,理论上讲,严格意义上的胚胎干细胞可以分化成除了胎盘组织以外的人体所有种类的细胞,也就是说我们想要什么细胞它就能变成什么细胞。
强大吧?我们前面讲到的那么多的成体干细胞和它一比,就都成了“小菜一碟”了。事实上,胚胎干细胞可变成各种各样的成体干细胞,再分化成我们要的细胞。
所以,做为种子细胞,胚胎干细胞将是再生医学的终极种子,现在所用的各种成体干细胞的疗法最终都将让位于胚胎干细胞。
·从胚胎发育到终极问题
“我是谁?我从哪里来?我又要到哪里去?”
这大概是每个人在成长过程中都会问自己的一个问题,这也是我们人类的一个终极问题。从笛卡尔的“我思故我在”到现代神经遗传学、进化心理学理论,人类一直在这个问题上不停地追问、不停地探讨。而研究胚胎的发育正是解决这个问题的一个关键。
读过生物的人都知道,每个胚胎发育的过程实际上也是一个生物进化的小规模重演,这是为什么呢?理论很多,但基本比较得到共识的看法是:生物的胚胎发育,是一个基因调控的过程,不同的基因依次被打开、关闭。由于这是一个信号一级一级地放大的过程,越早表达的基因,其后来的影响将会被越放越大。因此能够保留的突变一般发生在胚胎发育的晚期,因为如果突变发生在发育的早期,将会对后面的发育过程发生重大的影响,其结果往往是灾难性的。这样,那些较早表达的基因,往往是在进化史上较为古老的祖先基因,较晚表达的基因,则是后来逐渐加入的。因此胚胎发育的过程就是一个从祖先基因到新近基因的依次表达的过程,所以可以在此过程中重演进化过程的某些特征。
所以对胚胎发育的研究也是对进化过程的一种研究,正是解决我们从哪里来的这个终极问题的一个方面。我们可以通过研究早期胚胎哪些基因在何时打开何时关闭,来推测它们在生物体中的作用,乃至在整个生物进化中的作用,从而勾画出生物进化的全景。
还有,“我”是从哪里来的呢?“自我意识”是如何产生的呢?这是神经发育学要解决的一个问题。现在人们已经知道,人类早在胚胎期就已经有了意识,那么这些意识是从何时,从哪些细胞中开始产生的呢?“我”到底是如何认识到“我”的呢?这就要在胚胎的发育中寻找答案。但是我们总不能刨开妈妈的肚子研究里面的胚胎吧?所以从胚胎干细胞开始研究胚胎早期发育也是神经发育学的主要手段。
最后,通过研究胚胎干细胞来研究胚胎的早期发育,还有一个非常接近与实用的目的,就是改善人类的生殖。我们知道,大部分的流产实际上都发生在怀孕早期,而发生流产的原因多数都是胚胎发育出现了错误造成的。实际上很多畸形、遗传性疾病也都是在胚胎发育的早期就开始了,所以对胚胎干细胞的研究可以在根本上了解这些错误是如何造成的,最终避免在生育过程中发生这些错误,以达到优生优育的目的,并为广大不孕不育症患者带来福音,还给他们一个幸福的家庭。
·药物筛选和基因操作
胚胎干细胞也是研究人类疾病的良好模型。
一般研究一个疾病,最好就是可以有一个相应的动物模型,比如胰岛素的发明就得益于建立了狗的糖尿病模型。但对于大多数的人类疾病而言,人们都尚未建立相应的动物模型。还有一些疾病,如艾滋病、丙型肝炎等,致病的病毒只能感染人和黑猩猩,大大的限制了对这些疾病的研究。而胚胎干细胞因为可以分化成体内的各种细胞,我们就可以根据各种疾病发生的不同机制用胚胎干细胞来建立相应的疾病模型,从而研究疾病的发生、发展、并最终找到适宜的治疗方案。
比如,我们可以把建立某个疾病特异性的胚胎干细胞系,然后让它在体外向我们需要的方向分化,在分化的过程中观察和检测它的各种基因的表达与调控,对照正常的胚胎干细胞系的分化过程,我们就可以从中研究这个疾病发生的机制。
如果同时我们用不同的药物来处理这些细胞,我们就可以找出哪些药物可以调控这些病理机制,然后找出可以用于治疗这种疾病的候选药物。因为胚胎干细胞可以在体外无无限增殖,所以我们可用的细胞资源也是无限的,而细胞操作又相对比较容易,现代药物筛选已经可以做到大批量、规模化的扫描,一次就可以筛选成百上千个化合物。这种高通量的药物筛选正是当今药物开发的一个主流,在我们国家也正在如火如荼的开展,正是高科技、集约化经济的朝阳产业,必将在未来带动新兴科技产业的发展。
光是在细胞水平来进行疾病的研究和药物的筛选还是不够的,最终我们还是要做到个体水平。这样,基因敲除和基因打靶就登场了。
这两个技术就是前面讲到的与小鼠胚胎干细胞的发现一起,获得2007年诺贝尔奖的研究成果。其中,小鼠胚胎干细胞系的获得是它们的基础,因为所有的基因操作都是在胚胎干细胞的基础上进行的。
当然,其中还有另一个很重要的发现,就是基因的同源重组现象。同源重组就是人们发现在生物体中如果有一段外源的DNA在序列上与自身的DNA相同或非常相似时,就有可能发生同源重组,就是这一段外源的DNA结合到自身的DNA当中去,成为自身DNA的一段。因此,如果我们把某段基因的两端都加上一段与自身DNA相同的DNA序列,那么从理论上讲,我们就可以把这段基因整合到自身DNA中,替代掉原来存在于这个地方的那一段DNA(像不像“移花接木”大法?)。如果我们接入的这段DNA是无义的(就是没作用的)就是基因敲除,如果我们接入的DNA是为了达到某种目的的,比如突变、回复突变等,就是基因打靶。
基因敲除和基因打靶都必须是在胚胎干细胞上进行,一是因为胚胎干细胞增殖速度快,可以无限增殖,易于进行基因操作;另一个原因是胚胎干细胞在表观遗传学上与受精卵的特点最为接近,利用胚胎干细胞进行的基因操作更易于得到我们所需要的动物模型。
一般我们先用胚胎干细胞进行基因操作,也就是敲除或是打靶,得到基因被改变的细胞之后,把这种细胞的细胞核取出来,移植到小鼠的受精卵中,再将受精卵植入小鼠的子宫,那么发育出的个体就是我们所需要的经过基因改造的个体了。
现在基因操作的技术甚至可以做到给我们要操作的基因加一个分子开关,当我们需要它表达或不再表达时,只要加一些特定的药物刺激,就会使这个基因关闭或打开,这样我们就可以研究一个基因到底是在什么时候,什么位置发挥作用的,如果它在错误的时间、错误的地点表达又会发生什么事。这样做还可以研究一些非常重要的基因,比如对生物体来说生死攸关的基因,如果一下子就把它关闭了,这个生物体也许根本就无法出生,可是我们给它加了开关后,就可以等动物出生后在关闭或半关闭,然后研究它的生物学效应。
3.如何研究胚胎干细胞
我们如何来研究胚胎干细胞呢?
首先,是胚胎干细胞的分离与鉴定。
虽然到目前为止,我们已经分离到了多种小鼠和人的胚胎干细胞系还有好多种物种的胚胎干细胞系,但是,在胚胎干细胞系的分类和鉴定上还有很多的工作要做。就拿小鼠来说,有的品系就很容易得到胚胎干细胞系,可有的品系就怎么也得不到,为什么呢?我们要研究其中的机制。拿人类来讲,各种疾病模型的胚胎干细胞系当然也是非常有用的了。所以,寻求更为快捷、简单、高效的分离方法一直是各国科学界努力的方向。近年来炙手可热的诱导多能性干细胞就是这个方向上的一大突破。
分离之后就是鉴定了,前面我们已经讲过,干细胞以及胚胎干细胞都有它们自己的标志,需要通过鉴定它们来确定我们拿到的是不是真正的干细胞或胚胎干细胞。但其实因为各种胚胎干细胞在分化发育中所处的时期不同,所以其实它们之间还是有着千丝万缕的差别的,这也给了科学家们一个打口水仗的机会,除了一些大家公认的标志以外,总会有人提出新的标志,然后就会有人提出异议或讨论,吵个不亦乐乎。不过这就是科研的必经之路,甚至是科研的乐趣之一,吵吵更健康嘛!在这些争论中我们对胚胎干细胞理解就会一步一步的更为深入,更为接近它的真实本质。
但无论如何,胚胎干细胞的鉴定都有一个金标准的,对于人的胚胎干细胞,因为克隆人在伦理上的不许可,所以它的金标准是可以在免疫缺陷鼠的体内形成畸胎瘤,而这个畸胎瘤必须有发育完好的三个胚层的结构。
对于小鼠来讲,则是嵌合体和四倍体小鼠的形成。(不要误会,所谓四倍体小鼠并不是指小鼠的染色体加倍达到了四倍体,实际上出生的小鼠还是正常的二倍体,但其中会有一个四倍体的过程罢了。)
嵌合体和四倍体小鼠的形成都基于一个叫做“囊胚注射”的技术,这项技术也属于显微操作技术,就是把胚胎干细胞注射进入囊胚中让其发育成成体的一种实验手段。
如果注射入的囊胚是一个正常发育的囊胚,那注射进入的胚胎干细胞就与囊胚中已有的细胞一起发育、分化,最终形成嵌合体,也就是注射入的细胞与被注射的小鼠细胞混合形成的成体小鼠。在这种情况下,如果其中一只鼠是黑的,一只鼠是白的,那么出生的鼠就会是杂色的,毛色象奶牛一样是斑驳的。
如果我们取一个刚好分裂成为两个细胞的受精卵,用电融合的方法使它们重新变成一个细胞再发育,那么这个细胞发育出来的囊胚就只能形成胎盘(正常的胎盘实际上也是四倍体,不过是自然形成的),这时我们再把胚胎干细胞注射进入这个囊胚,得到的胚胎就是完全由我们注入的胚胎干细胞发育而来的,而不会有受体小鼠的细胞,胚胎干细胞来源小鼠是白色的,那出生的小鼠就是白色,黑色的就会是纯黑的,不会有杂色的情况出现。
四倍体小鼠是小鼠胚胎干细胞鉴定的终极手段,一个胚胎干细胞只要可以得到四倍体小鼠,就完全证明它是一株合格的胚胎干细胞,大家可以放心用了。
但在人体,这个办法是不能用的,因为这实际上就是克隆人,在各国都是被禁止的。所以人类胚胎干细胞的鉴定只停留在畸胎瘤的这一步,只要能在免疫缺陷的小鼠体内得到分化完全的畸胎瘤,我们就认定这是一株合格的人胚胎干细胞了。
其次,就是研究胚胎干细胞的自我更新能力。
胚胎干细胞是如何在体外不断增殖的同时又维持着不分化的状态的呢?我们知道,在我们的细胞中充斥着各种各样的蛋白,这些蛋白相互作用、相互影响,共同来完成各种各样的生理功能。这些蛋白相互作用的过程也是一个信息传递的过程,我们就称之为“信号通路”。胚胎干细胞自我更新的信号通路就是很多实验室研究的课题。这些信号通路并不是单一的,它们之间也互相影响、相互交叉,还与调节其他生理机制的信号通路相互联系和相互影响,共同构成一个立体的交叉网络。我们就是通过研究各个不同的蛋白以及它们与其他蛋白的相互关系,来研究到底是什么在影响着胚胎干细胞的自我更新。
第三,是胚胎干细胞的定向分化。
胚胎干细胞是有着强大分化潜能的一种细胞,如果我们不用各种各样的手段去抑制它的分化,它自己就会自发的发生分化,可是这种分化是不受控制的,分化出来的细胞也是混杂的,这是不能用于临床治疗和科学研究的。所以我们一定要研究胚胎干细胞的定向分化,让它们只朝一个方向分化,要向神经分化就都向神经分化,要向心肌分化就都向心肌分化。而且在这个过程中还要提防出现“南郭先生”,因为有的时候胚胎干细胞分化出的细胞看上去似模似样,和我们要的细胞很象,但实际上就是不干活――没有功能或功能不全。所以寻找胚胎干细胞定向的有功能的分化方法,也是研究胚胎干细胞的一个重要内容。
最后,胚胎干细胞的终极目标还是要应用于临床。
我们研究这么多,最终的目的还是要用它来治疗疾病。前面我们已经讲过,目前才开始世界上第一粒胚胎干细胞的人体移植实验,但是因为胚胎干细胞强大的自我更新及分化能力,它必然是未来再生医学的明日之星。如何应用胚胎干细胞治疗疾病,如何规避各种风险,如何降低成本,如何提高效率,这都是摆在科学家面前的问题。这些看上去成堆的难题在以科学研究为兴趣的科学家眼里就像是一大块令人垂涎欲滴的奶油蛋糕,引人遐思,欲罢不能。
4.胚胎干细胞研究中存在的问题
·伦理问题
胚胎干细胞研究的伦理问题,一直是一个争论的焦点。2001年8月,当时的美国总统布什签署总统令,禁止联邦资金用于提取胚胎干细胞及其研究,只能对当时已有的21种胚胎干细胞展开研究,致使美国的胚胎干细胞研究一度跌入低谷(不过其实世界上最好的干细胞科学家和实验室还是云集于美国的,没有哪个国家能够超越)。现在的美国总统奥巴马则在2009年3月9日签署总统令,宣布扩大联邦资金用于胚胎干细胞的研究。但有关胚胎干细胞研究的合法性的争论还远未平息,甚至与政治因素纠结在一起,影响着美国大选的走势。
胚胎干细胞研究的伦理问题涉及到了两个基本的道德原则:一、避免或减轻人类痛苦的原则;二、尊重人类生命价值的原则。这二者的核心是应该如何看待人类胚胎的道德地位。在这一点上有着各种各样的看法,主要有以下几种:
1.胚胎享有神圣创造物的特殊道德地位。这一般是宗教界人士的看法,小布什自称是虔诚的基督徒,所以秉持这种看法,坚决反对胚胎干细胞研究。
2.胚胎具有与人类等同的道德地位。这种观点认为人体的发育是一个连续的生理过程,没有绝对的分割线可以区分胚胎和成体不同的道德地位,没有理由否定胚胎阶段的人类也是人类,每一个人类个体都有享有维持躯体完整和生命延续的权利,所以破坏胚胎就等于杀人,是违反道德的。这也是小布什那来制定他的胚胎干细胞研究政策时的伦理依据。
3.胚胎具有潜在的人的道德地位。这种观点认为,早期胚胎虽然没有意识,没有心理、情感和智力,但是如果发育下去就有可能获得所有这些成体具备的特征,所以应该把胚胎看作是潜在的人,就像失去意识和行为能力的人一样应该得到与成体相同的尊严和道德尊重。
4.胚胎应受到道德尊重,但不具有与人类等同的道德地位。很多胚胎干细胞研究的科学家都秉持这样的观点。因为受精后发育到14天前的胚胎还没有中枢神经系统形成,没有感知和意识,不应该看作真正的人类个体,但它们是有着发育成人类个体的潜能的细胞,所以也应该得到一定程度的道德尊重。
5.胚胎仅仅是身体的一部分,不具有独立的道德地位。这种观点认为胚胎在发育到独立的个体前,仅仅是身体的一部分,就像是一个人的其他组织器官一样,是属于个人的财产,不具有独立的道德地位,应该尊重胚胎来源的个人的财产权。
在这个问题上,基于每个人的种族、宗教、受教育程度以及意识形态的不同,每个人都会有自己的看法和主张,很难取得统一的看法,也没有必要取得统一的看法。现代民主社会就应该是各种观念都能和谐相处嘛。所以聪明的科学家们想到的办法就是规避伦理问题。
最早的人类胚胎干细胞取自于被弃的人类体外受精的受精卵,它们本来是用于试管婴儿治疗不孕症的,如果不用于胚胎干细胞研究也会被抛弃。
后来由于各种伦理上的反对以及科学家们无穷无尽的好奇心,更多进行的是核移植的方法来获得胚胎干细胞,就是把一个成体细胞的核置换到一个卵细胞中,再让它发育成早期胚胎,以获取胚胎干细胞。这种方法获得的胚胎干细胞基本上与上一种方法得到的完全一样,但是在某些方面,特别是在表观遗传学上还是有所不同的,所以好奇的科学家们眼睛还是在盯着“原教旨主义”意义上的胚胎干细胞。
可是就连核移植得到的胚胎干细胞也是反对声一片,小布什就是其中一个。所以科学家们又另辟蹊径,日本的山中申弥首创以引入外源基因(也就是转基因)的方法,使成体的终末分化细胞重新回到最初的幼稚状态,就是现在最热的研究热点“诱导多能性干细胞”。当然,诱导多能性干细胞与“原教旨主义”意义上的胚胎干细胞还是存在着许多差异,但这实际上更激起了科学家们的好奇心,它们有哪些不同?为什么不同?什么机制导致了不同?如何消除这些不同?都是我们正在研究和将要研究的课题。
目前,世界各国对胚胎干细胞研究的管理有着不同的规定:日本、巴西、瑞士、加拿大、澳大利亚等国允许使用体外受精丢弃的受精卵获取胚胎干细胞;中国、韩国、印度、以色列、新加坡允许治疗性克隆的研究;英国是最宽松的,不但允许治疗性克隆,还允许在严格管理和监控下的生殖性克隆;美国则还在纠结中。
目前为止,在胚胎干细胞的伦理学上必较能得到共识的是:(1)胚胎干细胞研究有益于人类,要尊重;(2)胚胎的地位和权利也要得到尊重;(3)胚胎和卵子、精子不是商品,不能买卖,用于研究时必须遵守相关的法律法规;(4)生殖技术需要监督和控制;(5)坚决反对克隆人。
面对迅猛发展的胚胎干细胞研究,伦理问题确实是一个亟待解决的问题,但相信聪明的人类一定会在这中间寻找到一个平衡点的。
·免疫问题
要了解胚胎干细胞的免疫问题,首先要了解的是:什么是免疫?
免疫是生物体的一种生理功能,生物体可以依靠这种功能来识别异己,破坏和排除外来物和自身产生的不利于自身的物质,维持机体的生理平衡的一种功能。
它包括3方面的功能:(1)生理防御:抵御病原体及其毒性产物,抵御感染性疾病;(2)自身稳定:识别和清除机体新陈代谢中产生的衰老和死亡的细胞,保持机体稳定;(3)免疫监视:识别和消灭发生突变的细胞(比如肿瘤细胞),对细胞进行自身监视。
一句话,免疫系统就像军队和警察一样就是一个“排除异己”的系统。而要进行干细胞治疗、器官移植之类,就是要拿别人的东西混入到自己的身体里,还要让它们好好地为我们工作。可是免疫系统可不是那么好说话的,它可不管你是来干什么的,它只知道你不是自己人,不是自己人它就要把你挡出去或者干掉。所以规避免疫排斥就是器官移植和干细胞治疗的一件大事了。
最传统的办法是什么呢?是“对抗性”办法:你要把我干掉?哼哼!老子先把你干掉!用放疗、化疗的办法先把病人的免疫系统干掉,然后再进行移植。而且因为人类的免疫系统是非常强大的――“野火烧不尽,春风吹又生”,还要在以后的阶段不断地用免疫抑制剂来抑制免疫,让军队和警察不能发挥作用,直至移植进入的器官、细胞完全“化敌为我”为止。
这是一个相当危险和损伤极大的过程,很多病人还没等到“化敌为我”就因为没有了“军队和警察”而死于感染了;要么就是因为“军队和警察”的强烈反扑,而死于“抗宿主病”,无论是死于哪一种,都是悲剧啊!
除了“对抗性”的办法外,还有什么办法呢?其实我们前面讲到过,就是用“潜伏”的办法,间充质干细胞就是一种免疫原性很低的干细胞,用它来做干细胞移植,引起的免疫反应会比较低,那么相应地需要用的免疫制剂就会少很多,对身体的伤害就会小很多。
相对于间充质干细胞,胚胎干细胞是一种免疫原性更低的干细胞,所以它更好“潜伏”。但是无论如何,它还是一个外来物,要进行移植必然会引起免疫系统的反扑,所以如何在治疗中规避免疫排斥,一直是科学家们研究的一个热点。
一种办法是取得病人特异性的胚胎干细胞,就是想办法得到需要治疗的病人自己的胚胎干细胞,然后再用在病人自己身上。这样移植进入的也是“自己人”应该就不会有免疫反应了吧?但这还存在争论,有待进一步证明。
而且病人特异性胚胎干细胞并不容易取得,以前所用的方法主要是核移植,现在更火的是诱导多能性干细胞,两者都各有利弊。
另一种办法是进行基因改造,把所有的胚胎干细胞都改头换面,让它们都失去免疫原性,这样不就可以谁想用都可以了吗?但是人类细胞上的表面抗原成千上万,多数还具有重要的生理功能,这是一个巨大而复杂的工程;而且基因改造也不是那么容易做的,所以这个工作做的人并不多,不能算是主流。
·生物安全问题
胚胎干细胞的应用还存在着一个生物安全的问题。
首先,胚胎干细胞系是一个可以无限增殖的细胞系,这就有了成瘤性的风险。
要知道,肿瘤的发生,第一步就是细胞的无限增殖能力,其次才是转移性和侵袭性。肿瘤之所以是肿瘤,就是因为它不受控制的无限增殖。所以胚胎干细胞的应用,首先要解决的就是成瘤性。
但在这个问题上目前还没有什么好办法,因为无限增殖正好也是我们要使用它的一个特点,所以最好是体外无限增殖,体内就可控增殖,这也是胚胎干细胞学家们研究的一个方向。
其次,胚胎干细胞在体外培养时,无可避免的总会用到一些动物产品,比如胎牛血清啦什么的(不可能完全用人的血清来培养,成本太过于昂贵了),就算是现在已经开发出的无血清培养体系,其实里面还是添加了很多动物体内的提取物。这些动物产品的安全性就是一个问题,如果在移植过程中有所残留,会对人体产生什么样的影响很难估计。
而且动物体内是否会有病原物一起被带入也是一个问题。
大家说了,实验室那么干净的环境还会有病原菌吗?注意,这里提到的不是“病原菌”而是“病原物”,其实主要指的是“病毒”,有许多病毒在感染动物的时候是可以整合到动物的基因组里去的,可以随着动物的世代传递而传递下去,有的病毒在动物体内已经被同化了,可是到了人体后又可能会被激活,造成人体的疾病。
另外,造成“疯牛病”的朊病毒也是一个例子,它实际上是一种蛋白质,但却可以绕过消化系统破坏生物体的脑组织。大千世界无奇不有,谁知道还有什么类似的东东在动物体内等着作怪呢?这让我们怎么放心直接把接触过动物制品的细胞注入人体呢?
当然,免疫也是一个障碍,动物制品哪怕是再微量,对人体来说也是异物,对过敏体质的人来说就有可能是致命的。
所以,如何去除在胚胎干细胞培养(实际上成体干细胞也存在这个问题)的动物制品污染的问题也是干细胞应用领域的一件大事。做为生物安全的一个重要问题,各国的卫生监察部门都有着相应的严格的规章制度。但最釜底抽薪的办法还是让科学家们研究出不用动物制品就可以在体外大规模培养各种干细胞的方法。
最后,还有一个化学品污染的问题。
在胚胎干细胞的培养中,也无可避免的会用到很多的化学药品,这些化学药品对干细胞的自我更新和分化能力的维持也许是必不可少的,但一旦进入人体就有可能造成麻烦,所以在进入人体实验之前,这些化合物的安全性研究也是必不可少的。
目前,胚胎干细胞研究日新月异,被用来提高胚胎干细胞各种功能的化合物也越来越多,对它们的安全性的检测也是科学家们需要研究的一个方面。
总之,胚胎干细胞是再生医学干细胞治疗的明日之星,但如何安全、高效、便捷和便宜的应用,还有很长的路要走。
附件下载:

