

发布时间:2019-07-01
6月25日,《自噬》(Autophagy)在线发表了中国科学院广州生物医药与健康研究院刘兴国研究组的题为“Topology-dependent, bifurcated mitochondrial quality control under starvation”(饥饿条件下拓扑结构依赖的线粒体质量控制)的最新研究成果。线粒体自噬在发育、应激和病理过程中发挥着至关重要的作用,线粒体如何被识别主要在PINK1/PARKIN和受体介导等分子水平有报道,然而其多层次的选择过程与机制一直不清楚。这一工作提出了一种全新的依赖于细胞器拓扑结构的线粒体质量控制的选择策略。
线粒体,顾名思义,呈现线状或粒状,是高度动态的细胞器,它们频繁的发生融合和分裂,这是线粒体维持代谢功能以及调节在细胞中的作用不可缺少的。前期研究中,刘兴国博士等鉴定了线粒体融合的两种基本模式。除完全融合外,发现了新型融合方式“kiss-and-run”:两个线粒体靠近,交换可溶性物质再分离,而保持它们原来的形状不变(Xingguo Liu et al. EMBO J, 2009)。病理条件下,刘兴国博士等进一步发现缺氧/复氧导致线粒体呈现出一种特殊的线粒体环状形态——donut(Xingguo Liu et al. Cell Death Differ, 2011),并计算了其3D能量控制(Xingguo Liu*, Biophys J, 2015)。然而线粒体donut拓扑结构的功能目前还不清楚。Donut线粒体形如星空里贪婪的黑洞,又如那餐桌上诱人的甜甜圈,是否及怎样调控线粒体被吞噬再降解---即线粒体自噬呢?
通过自噬选择性清除线粒体是各种生理过程的关键策略,包括发育、细胞命运决定和应激反应等。线粒体自噬主要受PINK1/PARKIN和FUNDC1、BNIP3L等受体介导的途径调节,导致受损或不需要的线粒体被自噬体识别,吞噬,然后自噬体与溶酶体融合以降解线粒体(Xingguo Liu*, Autophagy, 2017)。然而,线粒体自噬的多层次机制,特别是选择过程的基本原理仍然模糊不清。
研究发现在血清饥饿的胁迫条件下,线粒体会经历拓扑结构变化,转化形成膨胀和donut线粒体。膨胀线粒体丢失线粒体膜电势并招募PINK1/PARKIN,从而促进其自噬降解;而donut线粒体保持线粒体膜电势从而抵抗线粒体自噬。膨胀和donut线粒体这两种线粒体形态均与线粒体通透性转换孔(Mitochondrial Permeability Transition Pore, mPTP)或钾离子通道开放相关,但程度不同。有趣的是,即使使用化学药物使线粒体去极化,donut线粒体仍能抵抗自噬,其虽然仍招募PINK1/PARKIN,但阻止自噬受体CALCOCO2/NDP52和OPTN的募集。
该研究揭示了基于线粒体形态结构来选择性控制线粒体质量和数量的新法则,可能在生理、病理、发育中发挥重要作用。值得一提的是,线粒体体积的控制因素-离子通道的作用是多方面的:线粒体通透转换孔的短时开放可以调控表观遗传(Xingguo Liu*, Cell Metab, 2016, 2018),长时开放可以凋亡(Xingguo Liu*, Hepatology, 2015),也可以通过线粒体形态结构调控选择性降解的命运。
仰观宇宙之大,宏大尺度的黑洞能吞噬一切物质;俯察细胞之盛,微小尺度的线粒体“黑洞”能抵抗被吞噬。而在细胞这一小房间里,自噬体如同溪头卧剥莲蓬的小儿无赖,以貌取食,挑食而不吃线粒体甜甜圈。
本研究获得国家重点研发项目、中科院、广东省实验室、国家自然科学基金、广东省和广州市的经费支持。
文章链接:https://doi.org/10.1080/15548627.2019.1634944
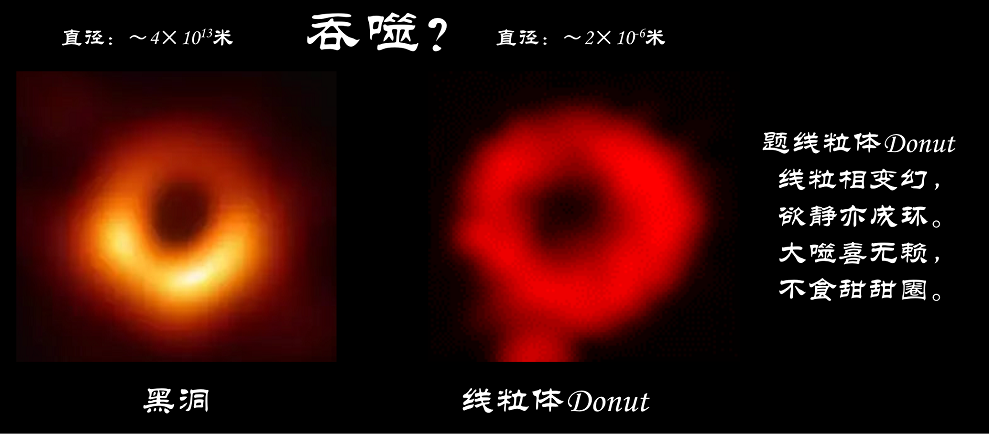
左侧图源:M87黑洞,事件视界望远镜(EHT)的人类首张黑洞照片
附件下载:

