

发布时间:2017-11-23来源:供稿:干细胞所 陈捷凯
北京时间11月22日凌晨,中国科学院广州生物医药健康研究院的裴端卿课题组、陈捷凯课题组合作在Cell系列子刊《Cell Reports》上以Article形式发表了题为“Kdm2b Regulates Somatic Reprogramming through Variant PRC1 Complex-Dependent Function”的研究论文,首次揭示KDM2B-PRC1复合物在iPS诱导重编程过程中的促进功能,并发现BMP信号通过削弱KDM2B-PRC1复合物在染色质上的结合并激活中内胚层基因的调节机制。这项表观遗传方向的基础研究成果阐述了一个参与细胞潜能调控的重要蛋白质机器的功能,并发现通过细胞环境调控该机器的机制,为未来诱导特定功能细胞提供了理论依据。
Polycomb Group(PcG)蛋白家族(多梳蛋白家族)是一类进化上极为保守的转录抑制因子,在发育基因的抑制中起到重要作用,和TrxG复合物(三胸复合物,主要与基因激活有关)是发育程序的“总开关”,是大部分高等多细胞生物正常发育所必须的,也是表观遗传领域的核心研究内容。PcG主要分为两个核心复合物PRC1和PRC2,近年来发现高等动物中PRC1复合物存在大量可变组分,这些非经典的PRC1复合物并不像经典PRC1复合物一样需要识别并通过H3K27me3招募至染色质,同时也呈现了更多变的转录调控现象,这些非经典PRC1的功能是PcG领域亟待探索的重要问题。
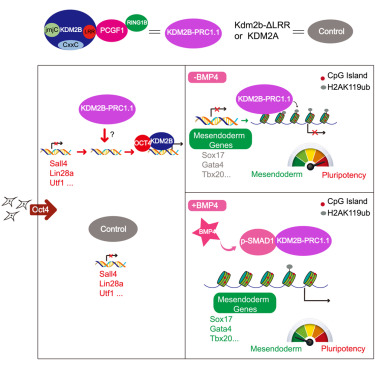
在近年来鉴定的非经典PRC1复合物中,KDM2B-PRC1.1复合物由于可以通过KDM2B的CxxC结构域募集到CpG富集的DNA序列(CGI)而倍受关注。KDM2B(又名JHDM1B、FBXL10、NDY1)是一个组蛋白H3K36二甲基化的去甲基化酶,但KDM2B和其同家族的KDM2A相比,除了相同的去甲基化酶活性和CGI结合能力外,还能通过其C端的LRR结构域结合PCGF1进而招募PRC1复合物(该复合物因PCGF1也称为PRC1.1复合物)。这也是PRC1.1复合物目前已知唯一的招募到染色质的方法,由于大部分基因、包括几乎全部发育相关的重要基因的启动子区都位于CGI,该位置的表观遗传修饰无疑对生命活动有着特殊的意义。因此,KDM2B-PRC1复合物自2012年底发现以来就受到广泛关注,但由于KDM2B蛋白具有多个功能结构域,单纯敲除或突变CxxC结构域的研究方式并无法排除其他结构域如去甲基化酶的活性的影响,目前关于该复合物直接的功能研究还很缺乏。
诱导多能干细胞(iPS细胞)是通过在体细胞中转入Oct4、Sox2、Klf4等转录因子,使体细胞逆转发育程序,重编程形成类似胚胎干细胞的多能干细胞的过程。这样一个使细胞“返老还童”的方法可以获得能分化成任意细胞类型的“万能细胞”,在个性化再生治疗上有着重要的意义。另一方面,由于体细胞重编程涉及到非常剧烈的细胞命运重塑过程,分化细胞重新恢复分化能力上的多能性,需要在表观遗传水平上抹除原有的分化程序并建立多能性干细胞的自我更新程序,因而是研究细胞命运转化及表观遗传调控的优秀细胞模型。
本研究沿继2012年本实验室关于维生素C可以通过KDM2A/KDM2B下调组蛋白H3K36me2水平促进体细胞诱导为iPS细胞的重编程的重要发现,使用KDM2A作为对照研究KDM2B-PRC1的功能。研究人员发现在Oct4介导的iPS诱导过程中,过表达Kdm2b相比于过表达Kdm2a,能更加显著地提升体细胞重编程效率。为确定这一促进功能对PRC1招募的依赖性,研究人员删除了Kdm2b负责招募PRC1的LRR结构域(KDM2B-ΔLRR),以及对Pcgf1等KDM2B-PRC1复合物关键因子进行敲降,这些结果都证明KDM2B对重编程的促进作用是依赖于PRC1的募集的。
陈捷凯博士等人在2011年曾报道BMP信号可以显著促进Oct4单因子诱导的iPS细胞形成,因此在该研究中,研究人员希望结合BMP信号和KDM2B来获得更高效的Oct4单因子重编程,出乎意料的是,两者同时使用时,重编程效率比单独加其中任何一者都要更低,这提示BMP信号会对KDM2B-PRC1进行调节。研究人员使用KDM2A和KDM2B-ΔLRR作为对照,证明PRC1的招募能力是出现这一抑制因素的原因。进一步的ChIP-seq实验表明,加入BMP后,KDM2B、H2AK119泛素化在CGI区的水平出现了显著的下降,后续研究表明,BMP下游的Smad1蛋白可以与KDM2B相互作用,并导致KDM2B在染色质上的结合能力下降。这种KDM2B-PRC1的结合削弱会导致显著的中内胚层基因表达,从而改变了细胞的命运走向。
本研究发现了KDM2B-PRC1.1复合物的一个显著的生物学功能,可以作为一个抓手进一步深入研究该复合物的生理功能。研究也以一个意料之外的结果作为契机,首次阐明了BMP信号调控KDM2B-PRC1的机制,进一步丰富了信号通路调控细胞命运决定的机制,也为通过胞外环境调节细胞表观遗传状态提供了新的理论基础。
广州生物院首次揭示KDM2B-PRC1在重编程中的功能
附件下载:

