

发布时间:2017-07-28来源:供稿:感染与免疫中心 余松林
6月9日,基因治疗领域权威杂志Human Gene Therapy在线发表了中国科学院广州生物医药与健康研究院陈小平课题组的最新研究成果
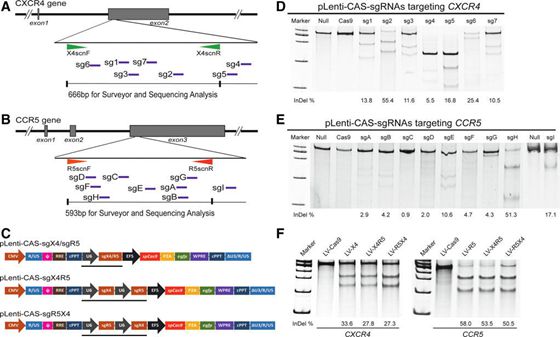
“Simultaneous knockout of CXCR4 and CCR5 genes in CD4+ T cells via CRISPR/Cas9 confers resistance to both X4- and R5-tropic HIV-1 infection”。该研究首次利用最新的CRISPR/Cas9基因编辑技术对人原代CD4+T细胞的两个重要受体CXCR4和CCR5基因进行双敲除,并对基因修饰过的T细胞进行体外的攻毒试验,证明双敲除的CD4+T细胞可以同时抵御X4-嗜性和R5-嗜性的HIV-1病毒株感染,为未来开展基于T细胞的艾滋病基因治疗提供了更为高效和安全的技术平台。该成果是博士研究生余松林等在导师陈小平研究员指导下完成的。
CD4+T细胞是HIV-1感染人体的主要靶细胞,也是艾滋病基因治疗的重要功能性细胞。CCR5是HIV-1感染CD4+T细胞的主要共受体。随着病毒感染的推进,病毒嗜性从R5-嗜性向X4-嗜性转变,并最终导致患者进展到AIDS期。因此,对于慢性期HIV-1感染者,同时敲除CXCR4和CCR5将可能阻断任何单一嗜性和双嗜性病毒的侵袭,从而提供双重保护,实现艾滋病的功能性治愈。
研究人员采用最新的CRISPR/Cas9基因编辑工具,通过改进传递方法,优化转染条件,最终实现了原代T细胞的多基因敲除。对修饰后细胞的功能验证表明CXCR4/CCR5双敲除的T细胞的生长和增殖能力,细胞凋亡水平与未修饰过的T细胞没有显著差异。但是,经过双受体基因修饰的CD4+T细胞可以有效抵御双嗜性HIV-1病毒株的感染。考虑到体内模型中,患者自身存在的HIV-1可以提供病毒选择压力,自然选择出CXCR4/CCR5基因敲除的CD4+T细胞,从而建立起对病毒的有效防护,因此可预期在体内研究中或可取得更为显著的抗病毒治疗效果。
该项目得到国家自然科学基金、科技部重点科技计划、广东省及广州市科技计划等的支持。
广州生物院在原代T细胞基因编辑和艾滋病基因治疗研究上取得新进展
附件下载:

