

发布时间:2016-01-14来源:Maple 供稿:干细胞所 刘静馨
1月5日,国际学术期刊Nature子刊Translational Psychiatry在线发表了中科院广州生物医药与健康研究院李志远研究组的研究成果:CRISPR/Cas9 facilitates investigation of neural circuit disease using human iPSCs: mechanism of epilepsy caused by an SCN1A loss-of-function mutation。这项研究中,研究人员将近年来迅猛发展的基因组编辑技术与iPSC来源的疾病模型结合起来,研究SCN1A(Nav1.1)功能丧失型突变导致癫痫的原因。
癫痫作为一种大脑兴奋性与抑制性失衡的疾病,涉及到兴奋性与抑制性神经元亚型及它们通过突触结构的相互作用。因而,其致病机制复杂,研究难度较大。Nav1.1突变对通道自身功能可造成“增强”与“丧失”两种截然相反的效果。关于功能丧失型的突变,目前的研究成果相互矛盾,加之这些研究使用的体系本身存在局限性,使得其致病机制雾里看花,尚难定论。在大脑中Nav1.1主要表达在GABA能神经元中,而在小部分谷氨酸能神经元中也有表达。Nav1.1具有偏好性的分布暗示,疾病起源于特定的神经元亚型,并且二者在疾病的发生中扮演不同角色。很明显,目前的iPSC疾病模型不能提供这样一个体系:既包含两种神经元的网络,同时又允许我们在电生理试验中能够精确的区分出其中的Nav1.1表达的亚型,以确保我们可以检测突变的直接效应、确定疾病根源。另一方面,目前利用iPS细胞模型的研究往往是基于具有不同基因背景的细胞株之间的比较,而众多的证据表明,基因背景可以影响疾病的临床症状的严重程度。总之,由于本身存在的局限性,使得利用iPSC模拟如癫痫之类的神经网络疾病处于困境。而基因编辑技术的出现及快速发展,为iPSC模型模拟神经网络类疾病的尴尬局面打开了一条出路。
研究人员通过在iPS细胞水平上敲入红色荧光蛋白基因来标记神经元网络中的GABA能神经元亚型,首次在病人来源的神经元网络中对表达Nav1.1的神经元亚型做了电生理检测。同时,对网络中自发抑制性及兴奋性突触后电活动进行了分析。研究发现,突变c.a5768G(在外源性转染体系中表现为无Nav1.1流)不仅影响表达Nav1.1的GABA能神经元上Nav总电流幅度的大小,而且影响Nav的通道激活性质。该变化进一步导致患者来源的神经元网络中的自发性抑制性突触后电流(sIPSCs)减弱。虽然自发的兴奋性突触后电流(sEPSCs)无显著性变化,但是,当进一步分析sIPSCs和sEPSCs的频率后,研究发现,患者来源的神经元网络突触后活动从抑制为主的状态转化为兴奋性为主的激发态,这表明,仅仅sIPSCs的变化就足以显著逆转神经元网络的兴奋性水平。
该研究成果填补了对SCN1A在外源转染体系上的突变效应与在内源性表达的神经元上的突变效应之间的关系认识上的空白,并揭示了SCN1A功能缺失突变所致的癫痫发生的根本生理学基础。
该研究获得科技部、国家自然科学基金、中科院、广东省和广州市的经费支持。
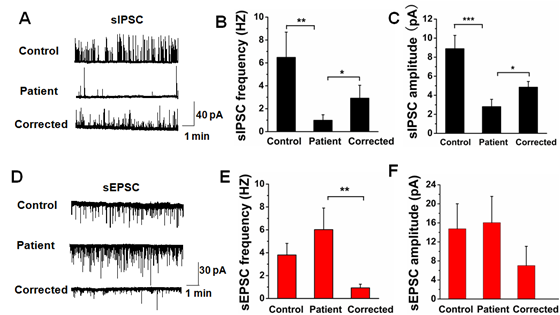
病人神经元网络中兴奋性自发性突触后电活动占主导地位
附件下载:

