

发布时间:2012-12-04来源:朱丹萍 供稿:干细胞所 陈捷凯
随着2012年度诺贝尔生理或医学奖的揭晓,诱导多能干细胞(iPS细胞)也变得家喻户晓。这项技术使得成体细胞“返老还童”为干细胞变为可能,因此具有极其广阔的再生医学应用前景。然而,尽管基于iPS细胞的各种研究热火朝天,但事实上这项研究并不容易,科研人员一直受困于iPS细胞诱导率低、速度慢、组成复杂等障碍。
日前,中国科学院广州生物医药与健康研究院裴端卿研究员、陈捷凯副研究员等人准确定位了iPS细胞诱导过程中一个极为重要的障碍,破解了产生障碍的原因并找到了清除这个障碍的办法。上述研究成果“H3K9 methylation is a barrier during somatic cell reprogramming into iPSCs”于12月2日在线发表在《Nature Genetics》(《自然·遗传学》)上。[http://www.nature.com/ng/journal/vaop/ncurrent/full/ng.2491.html]
在研究iPS细胞的过程中,裴端卿研究员及其团队发现iPS细胞诱导过程中大量出现一类细胞克隆,外观、生长速度等各方面酷似干细胞,却没有干细胞应有的基因表达和功能。这种“pre-iPS细胞”在经典的诱导环境中大量存在,而且状态稳定,严重阻碍科研人员获得真正的iPS细胞,包括iPS技术创始人Yamanaka在其第一篇关于iPS细胞的Cell文章上,获得的很多细胞株其实也只是这种pre-iPS细胞。然而,经过研究发现pre-iPS细胞在某些诱导条件下(比如用维生素C处理)也会变成真正的iPS细胞,可见这只是一种未完全重编程的iPS细胞,换句话说,这是个半成品。
裴端卿研究员及其团队意识到这种稳定的半成品代表了iPS诱导过程的一个重要关口,大部分细胞都被阻碍在这个关口门外,于是兵分两路,一路寻找这种半成品产生的条件,一路探索其转录调控情况。经过深入的研究,他们发现诱导培养iPS细胞所使用的血清是诱发这个障碍的元凶,尽管血清组成成分复杂,他们依然鉴定出起到主要抑制作用的成分——BMP蛋白,并用严谨的实验证实了BMP信号通路对重编程过程的抑制作用;另一方面,他们发现一个奇怪的现象,作为诱导iPS细胞四个因子之一的Oct4,尽管在半成品中表达量也非常高,却无法调控其在胚胎干细胞或真正iPS细胞中所调控的基因,经过检测,发现这些Oct4本应结合的位点,无一例外处于一种抑制的表观遗传状态!这就好比Oct4本该有一些下属,却都被锁在家里,无法被Oct4调动,而这些下属是否被调动,决定着细胞能否最终建立起多能性。结合这些结果,研究人员推测BMP信号通路与这个上锁的过程直接相关,并发现BMP信号的激活与其中一种称之为H3K9(组蛋白H3上的9位赖氨酸)甲基化直接相关,这种甲基化一般被认为是染色质浓缩化形成异染色质的标志。进一步实验说明,BMP信号通路能够通过调节H3K9的甲基转移酶来阻碍细胞进一步前进成为iPS细胞,而维生素C则可以依赖于H3K9的去甲基化酶清除这种障碍。为了鉴定这个障碍的重要性及其对应的酶,他们尝试用siRNA失活各种H3K9甲基化酶,结果发现,失活Setdb1这个酶可以使半成品细胞(pre-iPS细胞)在96小时内接近100%被继续重编程为真正的iPS细胞,因此Setdb1和H3K9甲基化被证实是iPS诱导过程中一个极其重要的障碍。
这项历时四年的研究结果抽丝剥茧,将iPS诱导过程中一个常见的重要障碍的形成原因和分子机理详细阐述清楚,不仅为克服不完全重编程障碍,促进iPS技术发展有显而易见的贡献,也提供了一个胞外信号通路经由表观遗传酶调节细胞命运的范例。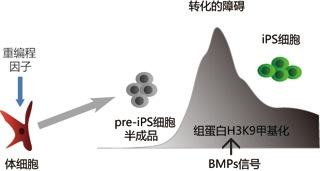
附件下载:

