

发布时间:2009-04-27
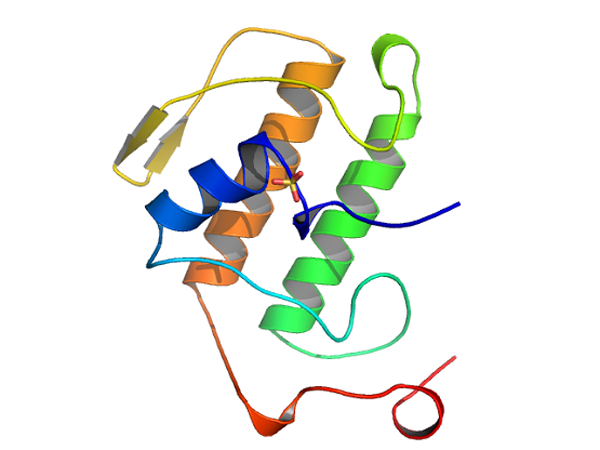
中国科学院广州生物医药与健康研究院刘劲松博士研究组在磷脂酶A2研究方面取得了重大研究进展。该项目组首次解析出了人磷脂酶A2 G1B酶原(Pro-hG1B)的高分辨率晶体结构。作为糖尿病,肥胖症等多种疾病的潜在药物靶标,Pro-hG1B晶体结构的解析无疑为药物的设计提供了重要的理论依据与指导。该研究成果已经在《The Journal of Biological Chemistry》电子版上发表。该工作由刘劲松博士与陈凌博士联合培养的博士生徐伟与刘劲松研究组助研易莉娜共同完成。
人磷脂酶A2 G1B已经有将近30年的文献报道,但一直未有晶体结构的报道。作为一个潜在的药物靶标,晶体结构的解析在药物研发中显得至关重要。经过近三年的努力,刘劲松博士研究组成功地表达纯化出具备膦脂水解活性的Pro-hG1B蛋白,并最终解析出了高分辨率的Pro-hG1B蛋白三维结构。进一步分析发现,在pro-hG1B结构中前面七个氨基酸的肽段占据了活性口袋位点,其周围的氨基酸形成了与丝氨酸蛋白酶相似的催化三联体空间构像。据此,研究组大胆提出并证实了pro-hG1B存在一定的自我剪切能力,这很可能是人磷脂酶A2 G1B蛋白一种新的激活方式。此外,还首次发现 pro-hG1B能形成一个功能性的三聚体,体外生化实验也证实了该三聚体的存在。在此基础上,研究组提出了一个全新的膜结合机制,更好地解释了hG1B水解游离底物与结合在膜上底物反应效率的差异。人G1B的结构解析为针对该靶标分子的药物设计提供重要的指导。
附件下载:

